La Fertirrigazione
MENU
FERTIRRIGAZIONE
Per fertirrigazione si intende la distribuzione di concimi con l'acqua di irrigazione. Questa tecnologia si è diffusa con l’impiego della irrigazione a goccia (e,in misura minore,nelle tecniche agricole fuori-suolo come la coltivazione idroponica e in contenitore).
Tra i vantaggi della fertirrigazione si possono citare la riduzione dei quantitativi di fertilizzanti,la non necessità di concimazioni di fondo e copertura,la disponibilità costante di nutrienti durante le diverse fasi di crescita,il risparmio di tempo e lavoro per automazione,la possibilità d’intervento nel caso di fisiopatie,la riduzione delle perdite per dilavamento,ecc. Gli unici relativi difetti sono rappresentati dal costo per l'impianto e una discreta conoscenza di chimica,presupposto per poter svolgere in modo adeguato diversi calcoli.Inoltre si può affermare che la fertirrigazione è una tecnica che include:
-Analisi del suolo
-Fabbisogno colturale dei nutrienti
-Bilancio previsionale per N,P e K (oppure metodo delle Schede)
-Analisi dell'acqua irrigua
-Bilancio idrico anche sulla base dei parametri metereologici
-Definizione dei turni irrigui
-Allestimento dell'impianto fertirriguo e a goccia.
A complicare l'utilizzo della tecnica di fertirrigazione contribuisce il fatto che per coltivazioni di diverse orticole,ognuna con specifiche esigenze,occorrono impianti più sofisticati.Tuttavia,anche grazie all'automazione,la fertirrigazione rappresenta l'esempio più significativo di concimazione di precisione. Tale precisione si basa sulla corretta applicazione di calcoli matematici,chimici,idrologici,ecc.
Chimica della Fertirrigazione
La concimazione per fertirrigazione consiste nel distribuire alle colture soluzioni acquose in cui sono disciolti i concimi chimici.Il solvente è rappresentato dall'acqua,il soluto è rappresentato dalla sostanza in essa disciolta.
Unità di misura della massa - la massa (erronemente definita peso)del soluto,ossia il concime chimico in forma solida (granuli,polveri,ecc)che viene disciolto nell'acqua,viene generalmente espressa in milligrammi mg,grammi g e chilogrammi Kg. Per convertire le unità di misura occorre sapere che:
1mg=0,001g e 1g=1000mg
1g=0,001Kg e 1Kg=1000g
1mg=0,000001Kg e 1Kg=1000000mg
Per i microelementi si utilizzano molto spesso i microgrammi μg. 1μg=0,001mg=0,000001g
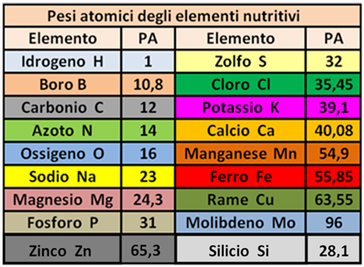
Peso atomico PA - E' il peso (massa) di un elemento.Per esempio l'Azoto N ha PA=14
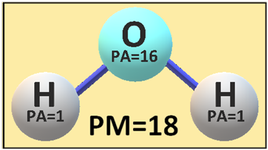
Peso molecolare PM - E' dato dalla somma dei pesi atomici degli atomi che costituiscono un composto. Per esempio l'Acido nitrico HNO3ha PM= 1+14+(16*3)= 63
Mole - Trascurando per semplicità il significato,in chimica si utilizzano molto spesso non solo le classiche unità di misura della massa ma soprattutto una unità di misura definita mole. Basti sapere che 1mole=g di sostanza/Peso molecolare della sostanza. Per es. 2g di Nitrato di Potassio KNO3=2/101,1=0,02moli.
Un sottomultiplo molto utilizzato della mole è la millimole,cioè 1mmole=0,001moli 1 e 1mole=1000mmoli.
Unità di misura del volume - le più utilizzate sono il Litro L e il millilitro mL.
1mL=0,001L e 1L=1000mL
E' anche importante sapere che 1L di acqua=0,001m3 e 1m3=1000L
1mg/L=1g/m3

Unità di misura della concentrazione - La grandezza che caratterizza una soluzione è denominata concentrazione e può essere espressa in vari modi:
Densità - E' il rapporto tra i g di una sostanza e il volume di solvente espesso in mL. Per es. la densità dell'Acido nitrico al 30% è pari a 1,13g/mL. Spesso la densità viene espressa in Kg/L ma è del tutto uguale a quella espressa in g/mL(1g/mL=1Kg/L).
Concentrazione molare o Molarità M - E' il numero di moli di una sostanza in un determinato volume in litri di soluzione M=moli/Vl. Analogamente la millimolarità è data da mM=mmoli/Vl.Per i microelementi si utilizza la micromolarità μM=μmoli/Vl.
1mole/L = 1000mmoli/L e 1mmole/L=0,001moli/L
1μmoli/L = 0,001mmoli/L e 1mmoli/L=1000μmoli/L
La concentrazione può essere rappresentata mediante diverse simbologie.Per es,l'Acido nitrico 2 molare può essere espresso come 2M=2moli/L o come [HNO3]=2M
Dalla concentrazione molare si possono ricavare le moli e quindi i grammi di un soluto in essa disciolto. Per esempio 1litro di soluzione 2M di KNO3 contiene moli KNO3=MV=2*1=2moli gKNO3=moli*PM=2*101,1=202,2g
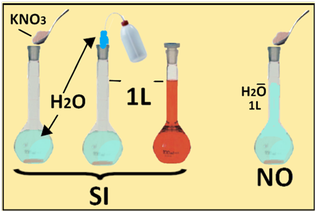
Occorre sottolineare che il volume della soluzione non è rappresentato dal solo solvente (acqua),ma dal solvente+soluto disciolto.Se si vuole per es preparare 1L di soluzione 2M di KNO3 i calcoli da effettuare sono
moli KNO3=MV=2*1=2moli gKNO3=moli*PM=2*101,1=202,2g
Si sciolgono quindi 202,2g di KNO3 in poca acqua e si porta a volume di 1L con l'acqua rimanente da aggiungere. Ciò è diverso ed errato dall'aggiungere 1L di acqua a 202,2g di KNO3.
Parti per milione ppm - è un'altro modo ancora per esprimere la concentrazione ed è pari a 1ppm=1mg/L=1g/m3
Per convertire le ppm in mmoli/L si ha che mmoli/L=ppm/PM oppure meq/L=ppm/PE
Calcoli stechiometrici - in chimica i calcoli che si effettuano riguardo alle reazioni vengono denominati stechiometrici e,così come per i calcoli matematici in cui si usano unità di misura come i ml,i Kg,ecc,in chimica si utilizza la mole o i suoi sottomultipli (mmole e micromole). Quando un sale (concime chimico) viene disciolto in acqua esso si dissocia nei suoi ioni costituenti. Per es. KCl→K++ Cl-;ZnSO4→Zn2++ SO42-
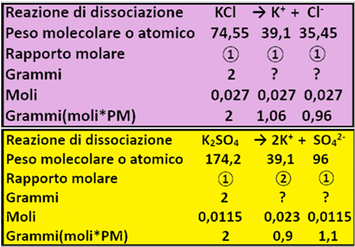
Trascurando il significato dell'apice,quello che si deve sapere è che per es,una molecola di KCl si dissocia in uno ione K+ e uno ione Cl-;il loro rapporto è quindi 1:1:1. Tali numeri esprimono anche il rapporto tra le moli,cioè 1 mole di KCl origina 1 mole di K+ e 1 mole di Cl-.
Una molecola di K2SO4 si dissocia come K2SO4→2K++ SO42-.
Trascurando la motivazione di tale dissociazione. In questo
caso il rapporto (detto rapporto stechiometrico)tra le moli è 1:2:1.
Dai rapporti tra le moli è possibile calcolare i quantitativi di tutte le specie chimiche di una reazione. Considerando nuovamente K2SO4,si ammetta di averne a disposizione 2g. Tale quantitativo in moli è pari a moli=g/PM=2/174,2 =0,01148moli aprrossimabili a 0,0115moli. Il rapporto tra le moli è 1:2:1 come visto in precedenza.Di conseguenza si risolve la proporzione 1:0,0115moli K2SO4=2:x x=2*0,0115/1=0,023 moli di K+.Per lo ione SO42- si ha 1:0,0115moli K2SO4=1:x x=1*0,0115/1=0,0115moli di SO42-. Infine si possono calcolare i grammi: SO42-=2g K+=moli*PA=0,023*39,1=0,9g SO42=moli*PM=0,0115*96=1,1g

Con un procedimento analogo si possono calcolare moli e grammi di un elemento contenuto in un composto.
Si considerino 2g di Tetraborato di sodio decaidrato (Borace) e si voglia calcolare il numero di moli e i grammi di Boro B.Il rapporto stechiometrico è 1:2:1 e di conseguenza Na2B4O72-*10H2O=2/201,2=0,01moli e B4O72-=0,01moli. In B4O72- il rapporto stechiometrico tra lo ione borato e il Boro B è pari a 1:4 e di conseguenza moli di B=0,01*4=0,04moli e g=moli*PM=0,04*10,8=0,43g.
Per convertire direttamente gli ioni nitrato,ioni ammonio,anidride fosforica,anidride solforica,ossido di potassio,ossido di calcio e ossido di magnesio rispettivamente in Azoto,Fosforo,Zolfo,Potassio,Calcio e Magnesio,si possono consultare le apposite tabelle.
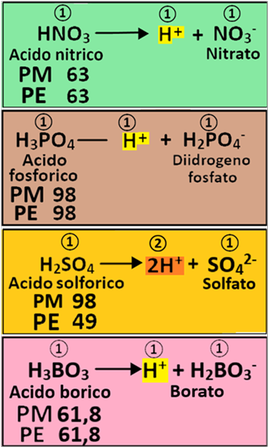
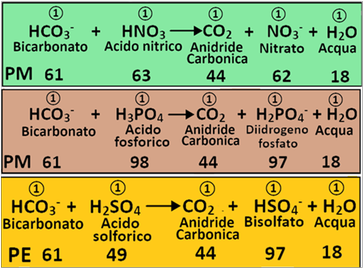
Dissociazione degli Acidi - Gli acidi in acqua si sciolgono,ossia si dissociano in modo particolare.L'Acido nitrico,il più utilizzato in fertirrigazione,si dissocia in acqua liberando ioni H+(caratteristici degli acidi) e ioni nitrato.In questo caso il rapporto stechiometrico tra acido nitrico,ioni H+ e ioni nitrato è pari a 1:1:1 moli.
L'acido fosforico invece si dissocia rilasciando 3 ioni H+ (in realtà ne rilascia uno per volta)e il rapporto stechiometrico tra acido fosforico,ioni H+ e ioni fosfato sarebbe 1:3:1.Tuttavia nei calcoli per la fertirrigazione si assume che l'acido fosforico si dissoci liberando uno ione H+ e ione diidrogenofosfato. Di conseguenza il rapporto stechiometrico tra acido fosforico,ioni H+ e ioni diidrogenofosfato diventa 1:1:1 moli.
Diverso è il caso dell'Acido solforico.Esso si dissocia liberando 2 ioni H+ (in realtà ne rilascia uno per volta) e uno ione solfato.Di conseguenza il rapporto stechiometrico tra acido solforico,ioni H+ e ioni solfato è pari a 1:2:1 moli.A causa di questo rapporto,senza specificarne il motivo per semplicità,si introduce il concetto di Peso equivalente PE al posto di Peso molecolare PM che risulta pari a PE=PM/n°di H+=98/2=49.Similmente si parla di Equivalenti Eq al posto delle Moli: Eq=g/PE.
Un ulteriore caso particolare è rappresentato dall'Acido borico H3BO3 che si assume, come nel caso dell'Acido fosforico che rilasci un solo H+.
Poichè L'acido nitrico,l'acido fosforico e l'Acido borico rilasciano un solo H+ il loro Peso equivalente è uguale al Peso molecolare e gli Equivalenti sono uguali alle moli.
Numeri espressi in notazione scientifica - si consideri la cifra 0,00000198;per evitare di scrivere un numero così lungo esso può essere scritto come 1,98*10-6 dove -6 è il numeri degli zeri e 1,98 è la cifra 198 con un decimale. Analogamente per la cifra 1980000000,si può scrivere 1,98*107 dove 7 è il numeri degli zeri e 1,98 è il numero 198con un decimale.
Approssimazioni - numeri come 0,138 si possono approssimare a 0,14 mentre numeri come 1,342 si possono approssimare a 1,34.
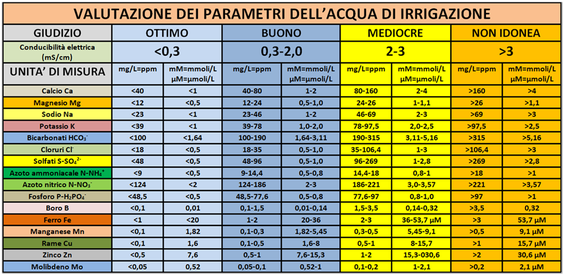
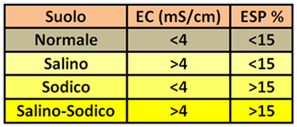
Acqua di irrigazione – Così come per la concimazione tradizionale è importante l’analisi del suolo,nella fertirrigazione, oltre a questa analisi occorre aggiungere anche quella dell’acqua utilizzata. I parametri di riferimento sono elencati in tabella. Elementi come Calcio e Magnesio possono essere talmente presenti nell'acqua irrigua da poter evitare di utilizzare concimi che apportino tali sostanze.Per la misura del contenuto in Azoto totale, Nitrati, Potassio, Fosforo,Magnesio,Calcio e Zolfo esistono in commercio fotometri da banco ad uso agricolo.Per i Microelementi,se necessario,ci si deve rivolgere a laboratori di analisi.

Particolare attenzione deve essere rivolta al contenuto in Boro nell'acqua irrigua:tale elemento è molto importante per diverse colture ma è tossico anche se presente in quantità appena eccessive ed è inoltre non lisciviabile dal suolo.
Parametri fondamentali nella tecnica di fertirrigazione sono la Conducibilità elettrica EC e il pH dell'acqua irrigua, della soluzione nutritiva,del terreno,ecc,che devono essere frequentemente monitorati.
Il pH-metro deve essere tarato prima dell'uso con soluzioni a pH noto(pH 5,5-6,2) e l'elettrodo deve essere tenuto immerso in acqua distillata dopo l'uso per non far seccare la membrana.
L'utilizzo di acidi agevola anche la dissoluzione dei concimi e,in vase al pH ottenuto,l'assorbimento selettivo di determinati nutrienti da parte delle colture.
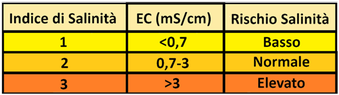
 Salinità e Conducibilità elettrica - La salinità esprime il contenuto di sali solubili nell'acqua irrigua e/o nel suolo e viene misurata generalmente in termini di Conducibilità elettrica EC.L'unità di misura dell'EC è il Siemens su cm (S/cm)ma di solito vengono utilizzati i suoi sottomultipli mS/cm e µS/cm.A volte viene utilizzato il dS/m che è uguale al mS/cm.
Salinità e Conducibilità elettrica - La salinità esprime il contenuto di sali solubili nell'acqua irrigua e/o nel suolo e viene misurata generalmente in termini di Conducibilità elettrica EC.L'unità di misura dell'EC è il Siemens su cm (S/cm)ma di solito vengono utilizzati i suoi sottomultipli mS/cm e µS/cm.A volte viene utilizzato il dS/m che è uguale al mS/cm.1mS/cm=1dS/m=0,001S/cm=1000µS/cm
Il valore ottimale dell'EC dell'acqua irrigua è <0,7mS/cm mentre l'EC ottimale per il substrato(per es. il suolo ECe) è <4mS/cma .Il valore ottimale dell'EC per le colture e quindi della soluzione nutritiva varia da specie a specie ma in genere assume valori pari a 2-3mS/cm.
La misurazione dell'EC dell'acqua irrigua si esegue semplicemente prelevando un campione dell'acqua immessa nell'impianto di fertirrigazione e immergendo un Conduttivimetro. Allo stesso modo si può controllare il valore della soluzione nutritiva prelevandone un campione all'uscita adell'impianto.
Il valore di EC varia con la temperatura;tuttavia molti conduttivimetri calcolano automaticamente la variazione.In caso contrario occorre effettuare delle conversioni.
Come per i pHmetri,anche i Conduttivimetri devono essere periodicamente tarati con soluzioni a salinità nota (1-4mS/cm) e l'elettrodo deve essere immerso in acqua distillata o in apposite soluzioni.
Più complessa è la determinazione della EC del substrato (suolo).I metodi utilizzati sono rappresentati da:
 Estrazione in pasta satura ESP - metodo accurato ma poco pratico.La pasta satura si ottiene impastando il terreno con la quantità minima di acqua necessaria a formare una “pasta” di densità tale che la lama di un coltello strisciata in essa lasci un solco aperto.Centrifugando la pasta satura si ha una separazione delle particelle solide e di una frazione liquida che costituisce appunto l’estratto di pasta satura.Il valore di ESP è pari a ESP=[Sodio scambiabile]/CSC*100.La tabella indica il rapporto esistente tra contenuto in sodio nella pasta satura e la conducibilità elettrica.Il valore ottimale è pari a ESP<15% e EC<4mS/cm (optimum a 1,5-2,7mS/cm).
Estrazione in pasta satura ESP - metodo accurato ma poco pratico.La pasta satura si ottiene impastando il terreno con la quantità minima di acqua necessaria a formare una “pasta” di densità tale che la lama di un coltello strisciata in essa lasci un solco aperto.Centrifugando la pasta satura si ha una separazione delle particelle solide e di una frazione liquida che costituisce appunto l’estratto di pasta satura.Il valore di ESP è pari a ESP=[Sodio scambiabile]/CSC*100.La tabella indica il rapporto esistente tra contenuto in sodio nella pasta satura e la conducibilità elettrica.Il valore ottimale è pari a ESP<15% e EC<4mS/cm (optimum a 1,5-2,7mS/cm).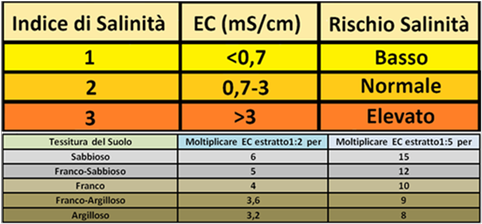 Estrazione acquosa in rapporto 1:2 e 1:5 - metodo meno accurato ma semplice. In una vaschetta si pone un campione di suolo e lo si inumidisce fino a che sul fondo del contenitore o in superficie si ha un velo di acqua.In un altro contenitore graduato di almeno 1 litro e munito di coperchio si introducono,per es.,60ml di acqua distillata e il campione di suolo inumidito fino a raggiungere il volume totale di 90ml.Si chiude il contenitore,si agita per 5 minuti,e dopo 15 minuti si filtra la soluzione nella quale si misura l'EC con un Conduttimetro.
Estrazione acquosa in rapporto 1:2 e 1:5 - metodo meno accurato ma semplice. In una vaschetta si pone un campione di suolo e lo si inumidisce fino a che sul fondo del contenitore o in superficie si ha un velo di acqua.In un altro contenitore graduato di almeno 1 litro e munito di coperchio si introducono,per es.,60ml di acqua distillata e il campione di suolo inumidito fino a raggiungere il volume totale di 90ml.Si chiude il contenitore,si agita per 5 minuti,e dopo 15 minuti si filtra la soluzione nella quale si misura l'EC con un Conduttimetro.L'estrazione in rapporto 1:5 si esegue nello stesso modo variando i rapporti acqua-campione.
I risultati si confrontano con valori di riferimento tabulati.
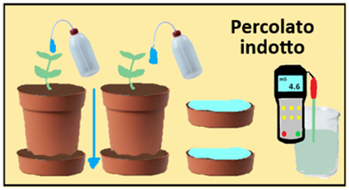 Metodo del Percolato indotto - si utilizza per colture in vaso ma con qualche accorgimento può essere utile anche per colture in campo.sotto alcuni vasi in cui vengono coltivate le stesse piante si collocano dei sottovasi. Si bagna dall’alto con un volume noto (100ml) di acqua distillata e si raccoglie l’acqua che percola nei sottovasi. Si raccoglie un campione d’acqua percolata per ogni sottovaso,si mescolano e si procede alla misura dell’EC con un Conduttivimetro.
Metodo del Percolato indotto - si utilizza per colture in vaso ma con qualche accorgimento può essere utile anche per colture in campo.sotto alcuni vasi in cui vengono coltivate le stesse piante si collocano dei sottovasi. Si bagna dall’alto con un volume noto (100ml) di acqua distillata e si raccoglie l’acqua che percola nei sottovasi. Si raccoglie un campione d’acqua percolata per ogni sottovaso,si mescolano e si procede alla misura dell’EC con un Conduttivimetro.La Conducibilità elettrica è un parametro che deriva dal fatto che i sali disciolti in acqua si dissociano nei loro ioni costituenti,che avendo una carica elettrica,sono in grado appunto di condurre elettricità.Una importante proprietà della Conducibilità elettrica dell'acqua irrigua è rappresentata dal fatto che si deve ottenere un equilibrio ionico,ossia la somma delle concentrazioni degli ioni positivi(cationi) deve essere uguale o molto simile a quella degli ioni negativi(anioni).
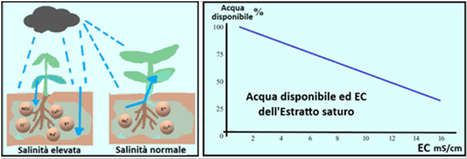 La Conducibilità elettrica è anche strettamente legata al concetto di osmosi.E' infatti noto che l'acqua passa spontaneamente da una soluzione più diluita ad una più concentrata fino a raggiungere un equilibrio.Ne deriva che se nella soluzione acquosa circolante a livello delle radici persiste un'alta concentrazione di ioni,ossia un'alta salinità e quindi un'alta Conducibilità elettrica,tali ioni richiameranno acqua dalla pianta con conseguente disidratazione.Poichè l'osmosi è un parametro difficle da misurare,si utilizza la Conducibilità elettrica.
La Conducibilità elettrica è anche strettamente legata al concetto di osmosi.E' infatti noto che l'acqua passa spontaneamente da una soluzione più diluita ad una più concentrata fino a raggiungere un equilibrio.Ne deriva che se nella soluzione acquosa circolante a livello delle radici persiste un'alta concentrazione di ioni,ossia un'alta salinità e quindi un'alta Conducibilità elettrica,tali ioni richiameranno acqua dalla pianta con conseguente disidratazione.Poichè l'osmosi è un parametro difficle da misurare,si utilizza la Conducibilità elettrica.Sostanze caratterizzanti - si tratta di sostanze disciolte nell'acqua che,in alcuni,casi,oltre ad avere azione nutritiva per le piante,devono essere attentamente monitorate per non creare squilibri di pH,EC,fito-tossicità e malfuzionamenti dell'impianto irriguo.
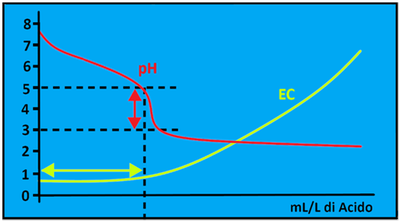 Carbonati e Bicarbonati - I Carbonati e soprattutto i Bicarbonati nell’acqua irrigua se da un lato rappresentano un rischio per la formazione di Calcare,dall’altro lato conferiscono alcune importanti proprietà. Innanzitutto impediscono alle soluzioni acquose si incombere in una brusca variazione di pH comportandosi da sostanze tamponanti. Inoltre,dal grafico,si può notare che quando si aggiunge un acido,il pH ad un certo punto scende velocemente da 5 a 3 e questa improvvisa variazione nuoce alle colture. Per tale motivo le soluzioni acquose nutritive si preparano aggiungendo acidi senza che il pH scenda sotto il valore di 5. Inoltre l’EC rimane praticamente costante quando il pH è mantenuto a valori di 5-6. A queste condizioni è quindi possibile apportare Azoto,Fosforo e Zolfo rispettivamente con Acido nitrico,fosforico e solforico senza incidere significativamente sull’EC.L’importanza dei Bicarbonati come agenti tamponanti risulta particolarmente evidente quando si utilizza acqua piovana (praticamente priva di Bicarbonati) per l’irrigazione;in tal caso l’acqua deve essere addizionata di piccole quantità di Bicarbonato di sodio NaHCO3 o di potassio KHCO3(ovviamente in questo modo si apportano anche Sodio o Potassio).
Carbonati e Bicarbonati - I Carbonati e soprattutto i Bicarbonati nell’acqua irrigua se da un lato rappresentano un rischio per la formazione di Calcare,dall’altro lato conferiscono alcune importanti proprietà. Innanzitutto impediscono alle soluzioni acquose si incombere in una brusca variazione di pH comportandosi da sostanze tamponanti. Inoltre,dal grafico,si può notare che quando si aggiunge un acido,il pH ad un certo punto scende velocemente da 5 a 3 e questa improvvisa variazione nuoce alle colture. Per tale motivo le soluzioni acquose nutritive si preparano aggiungendo acidi senza che il pH scenda sotto il valore di 5. Inoltre l’EC rimane praticamente costante quando il pH è mantenuto a valori di 5-6. A queste condizioni è quindi possibile apportare Azoto,Fosforo e Zolfo rispettivamente con Acido nitrico,fosforico e solforico senza incidere significativamente sull’EC.L’importanza dei Bicarbonati come agenti tamponanti risulta particolarmente evidente quando si utilizza acqua piovana (praticamente priva di Bicarbonati) per l’irrigazione;in tal caso l’acqua deve essere addizionata di piccole quantità di Bicarbonato di sodio NaHCO3 o di potassio KHCO3(ovviamente in questo modo si apportano anche Sodio o Potassio).Il Calcio,sotto forma di ioni Ca2+,è un nutriente che non possiede tossicità per le piante ma che se presente in quantità eccessiva si combina con i Carbonati e Bicarbonati portando alla formazione di calcare che intasa le tubature. Unitamente al Magnesio costituisce la cosiddetta Durezza dell'acqua che si misura in gradi francesi °F o in gradi tedeschi °dH (°F=ppm CaCO3/ 10;°dH = °F / 1,79).
Il Sodio se presente nell'acqua in quantità eccessiva è fito-tossico e peggiora la struttura del suolo,a meno che non siano presenti Calcio e Magnesio in buon quantità.Il rischio dovuto al Sodio si può quantificare tramite un parametro definito  .La SAR è ritenuta eccessiva se >10.
.La SAR è ritenuta eccessiva se >10.
Anche il Cloro se eccessivo (intorno a 700mg/L nel suolo)è fito-tossico. Occorre notare che nelle zone costiere l'acqua del mare trasportata anche dal vento come salsedine è costituita in gran parte proprio da NaCl,ossia sia da sodio sia da cloro.
Lo Zolfo,sotto forma di ioni solfato SO42- è un nutriente in genere ben tollerato dalle piante.Tuttavia se presente nell'acqua in quantità eccessiva può alterare l'equilibrio ionico.
Il Boro può diventare tossico quando la sua concentrazione supera anche di poco quella ottimale.
Eccesso di microelementi nell'acqua - I microelementi sono indispensabili per le colture ma se presenti in quantità eccessiva sono fito-tossici.Il Ferro e il Manganese,in particolare,possono formare composti rossastri che intasano le tubature degli impianti.
Alghe,Batteri e Solidi sospesi - Le alghe possono produrre melme gelatinose che occludono le tubature. Ingenti colonie di batteri possono occludere gli ugelli. I solidi sospesi come residui di foglie,sabbia,terra,ecc, possono ovviamente creare malfunzionamento degli impianti.
Neutralizzazione dei Bicarbonati - Nell’acqua di irrigazione sono sempre presenti carbonati e soprattutto bicarbonati che rendono il pH alcalino. Dal momento che il valore adeguato di pH per l’acqua di irrigazione è pari a 5,5-6,5 con un optimum a pH=6 ,i bicarbonati devono essere in parte neutralizzati mediante l’aggiunta di acidi. La neutralizzazione parziale e non totale si spiega per il fatto che una certa quantità di bicarbonati deve essere mantenuta in soluzione in modo tale da mantenere,ossia tamponare,il pH intorno a valori 5,5-6. Normalmente tale quantitativo si aggira tra 0,1 e 1,0 mmoli/L,quindi in media 0,5mmol/L.
 Acidi utlizzati:
Acidi utlizzati:- Acido nitrico - E' l'acido maggiormente utilizzato, in particolare quello con un titolo del 65% o del 67%. Apporta nitrati che possono essere sufficienti per la concimazione azotata.
- Acido fosforico - Viene utilizzato in particolare quello con un titolo dell'85% e apporta fosforo in quantità spesso sufficienti per la concimazione fosfatica. Impropriamente si considera monoprotico,cioè si ammette che rilasci 1 solo ione H+ invece di 3.
- Acido solforico - poco utilizzato e comunque con un titolo in genere del 95%.Apporta molto zolfo.
- Acido cloridrico - usato assai raramente per il suo contenuto in Cloro.
 Tutti questi acidi sono estremamente pericolosi da maneggiare per chi non è pratico.Sono infatti molto corrosivi ed inoltre,soprattutto l'Acido solforico, tendono a reagire con l'acqua sviluppando calore e a volte schizzi pericolosi. La regola da seguire scrupolosamente è quella di aggiungere l'acido a piccole porzioni all'acqua e non il contrario,cioè l'acqua all'acido. A questa regola si aggiunga l'obbligo di indossare dispositivi di protezione,in particolare gli occhiali.In caso di sversamenti non utilizzare mai segatura o altro materiale organico,ma sabbia. Occorre prestare attenzione anche al fatto che gli acidi corrodono i metalli,sia quelli facenti eventualmente parte dell'impianto di fertirrigazione sia quelli eventualmente utilizzati nella concimazione (ferro,zinco,rame,ecc)con sviluppo di idrogeno potenzialmente esplosivo. Tutte queste avvertenze non devono prestare allarmismo se si seguono gli opportuni accorgimenti,ma occorre considerare che tali acidi si utilizzano in quantità e non a gocce.
Tutti questi acidi sono estremamente pericolosi da maneggiare per chi non è pratico.Sono infatti molto corrosivi ed inoltre,soprattutto l'Acido solforico, tendono a reagire con l'acqua sviluppando calore e a volte schizzi pericolosi. La regola da seguire scrupolosamente è quella di aggiungere l'acido a piccole porzioni all'acqua e non il contrario,cioè l'acqua all'acido. A questa regola si aggiunga l'obbligo di indossare dispositivi di protezione,in particolare gli occhiali.In caso di sversamenti non utilizzare mai segatura o altro materiale organico,ma sabbia. Occorre prestare attenzione anche al fatto che gli acidi corrodono i metalli,sia quelli facenti eventualmente parte dell'impianto di fertirrigazione sia quelli eventualmente utilizzati nella concimazione (ferro,zinco,rame,ecc)con sviluppo di idrogeno potenzialmente esplosivo. Tutte queste avvertenze non devono prestare allarmismo se si seguono gli opportuni accorgimenti,ma occorre considerare che tali acidi si utilizzano in quantità e non a gocce.La neutralizzazione dei bicarbonati con acidi è fondata su una reazione che porta alla formazione di acqua e anidride carbonica che essendo un gas si disperde nell’aria: HCO3-+ H+→ H2O + CO2
Diversi sono i metodi che si possono utilizzare per calcolare la quantità di acido che occorre per la neutralizzazione dei Bicarbonati:
 Metodo con formule - Si basa sulla applicazione di formule(di cui si tralasciano per semplicità le dimostrazioni) che hanno il vantaggio di poter calcolare la quantità di acido da utilizzare a qualsiasi pH,oltre a quello di valore 5,5 e 6.
Metodo con formule - Si basa sulla applicazione di formule(di cui si tralasciano per semplicità le dimostrazioni) che hanno il vantaggio di poter calcolare la quantità di acido da utilizzare a qualsiasi pH,oltre a quello di valore 5,5 e 6.Si ammetta,per es., che l’acqua utilizzata per la fertirrigazione abbia contenga 160mg/L di ioni bicarbonato.
Avendo a disposizione Acido nitrico al 65% (d=1,39Kg/L),la quantità da utilizzare per portare il pH della soluzione ad un valore pari a 5,5 viene fornita tramite i seguenti metodi e calcoli:
[HCO3-]=160mg/L/61=2,62 meq/L
[HA] = [HCO3-]/(1+10pH-6,35)
[HNO3]= 2,62 /(1+105,5-6,35) = 2,62 /(1+10-0,85) = 2,62 /(1+0,141)= 2,62 /1,141= 2,3 meq/L
Q = [HA] • PE / (10 •d • T)
Q = (2,3*63)/(10*1,39*65) = 144,9/903,5= 0,16 ml/L
Si ammetta ora di utilizzare Acido fosforico al 75%(d=1,58Kg/L) e di voler portare il pH al valore di 6.
[HCO3-]=160mg/L/61=2,62 meq/L
[HA] = [HCO3-]/(1+10pH-6,35)
[H3PO4]= 2,62 /(1+106-6,35) = 2,62 /(1+10-0,35) = 2,62 /(1+0,447)= 2,62 /1,447= 1,81 meq/L
Q = [HA] • PE / (10 •d • T)
Q = (1,81*98)/(10*1,58*75) = 177,4/1185= 0,15 mL/L
Infine,si ammetta di utilizzare Acido solforico al 53%(d=1,58Kg/L) e di voler portare il pH al valore di 6.
[HCO3-]=160mg/L/61=2,62 meq/L
[HA] = [HCO3-]/(1+10pH-6,35)
[H2SO4]= 2,62 /(1+106-6,35) = 2,62 /(1+10-0,35) = 2,62 /(1+0,447)= 2,62 /1,447= 1,81 meq/L
Q = [HA] • PE / (10 •d • T)
Q = (1,81*49)/(10*1,58*53) = 88,69/837,4= 0,106 ml/L
Metodo con reazione chimica - Si basa sul fatto che gli ioni Bicarbonato presenti nell'acqua vengono neutralizzati in parte dall'acido, lasciandone 0,5 meq/L.Tramite considerazioni sulla reazione chimica di cui si omette la spiegazione,si ricava la quantità di acido da utilizzare. Nel caso dei tre esempi precedenti:
 HCO3- da neutralizzare = meq-0,5= 2,62-0,5=2,12 meq/L
HCO3- da neutralizzare = meq-0,5= 2,62-0,5=2,12 meq/LHNO3 necessario = mmoli*PE= 2,12 *63=133,56mg/L
133,56*100/65= 205,48 mg/L
Q = 205,48*(65/100000) = 0,13mL/L
HCO3- da neutralizzare = meq-0,5= 2,62-0,5=2,12 meq/L
H3PO4 necessario = mmoli*PE= 2,12 *98=207,76mg/L
207,76*100/75= 277mg/L
Q = 277*(75/100000) = 0,2mL/L
HCO3- da neutralizzare = meq-0,5= 2,62-0,5=2,12 meq/L
H2SO4 necessario = mmoli*PE= 2,12 *49=103,88mg/L
103,88*100/53= 196mg/L
Q = 196*(53/100000) = 0,103mL/L
A prescidere dal metodo,i risultati sono uguali o molto simili.
L'utilizzo di acidi per la neutralizzazione dei bicarbonati apporta inevitabilmente anche sostanze nutrive (Azoto,Fosforo o Zolfo) di cui tenere conto. A volte è necessario ricorre a più di un acido.Quando l’aggiunta di acido nitrico per neutralizzare i bicarbonati causa un apporto di azoto superiore al fabbisogno,si ricorre per es. anche all'acido fosforico in una quantità che tenga conto del bicatbonato già neutralizzato dall'acido nitrico.
Un altro aspetto da considerare è la produzione di Anidride carbonica che essendo un gas deve essere libera di fuoriuscire dai contenitori.L'aggiunta di acidi dovrebbe provocare l'aumento dell'EC ma,poichè vengono neutralizzati i bicarbonati,il loro effetto è trascurabile.
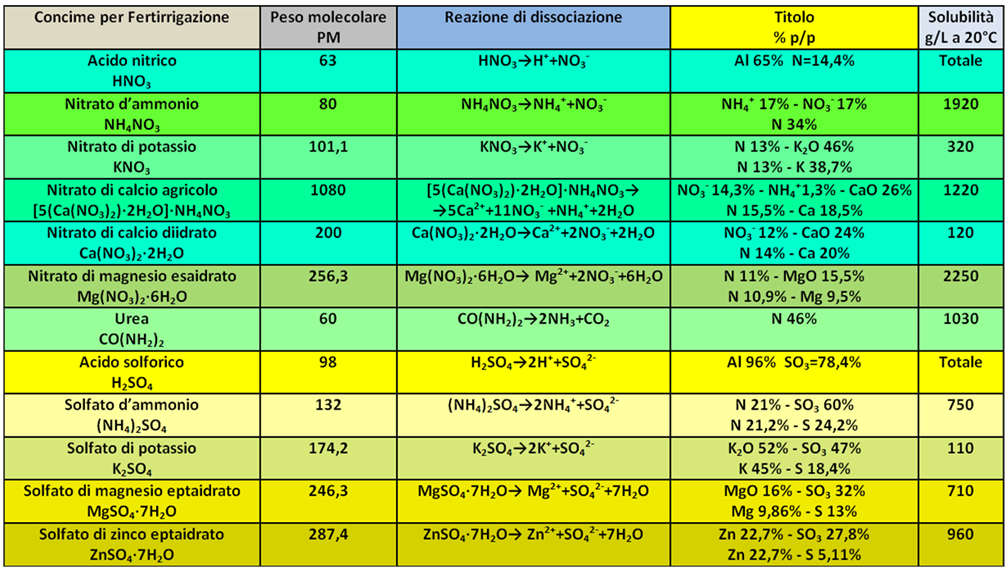
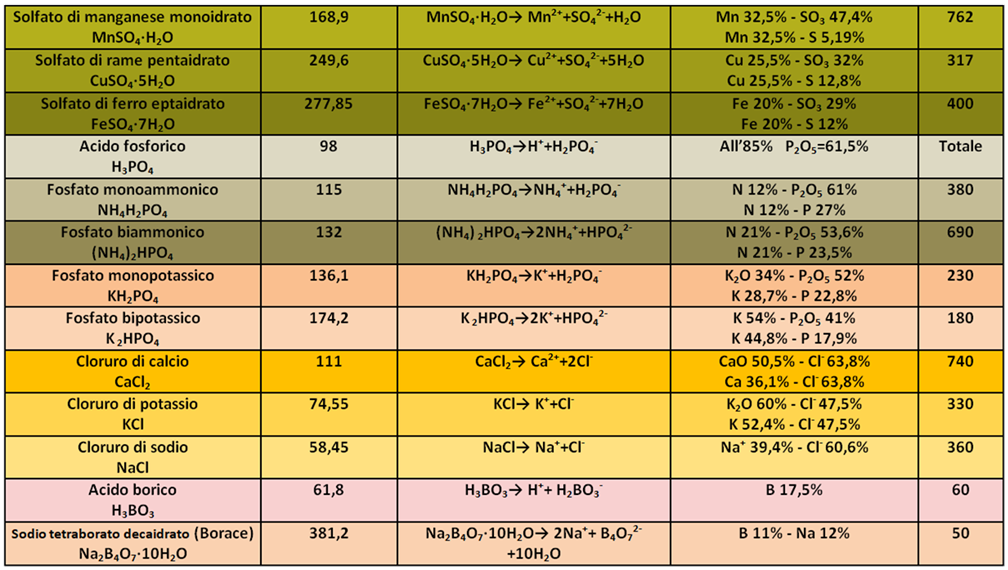
Concimi chimici per Fertirrigazione
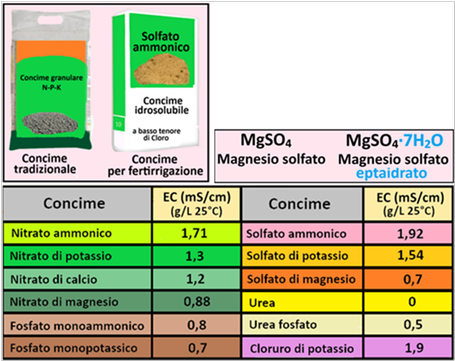 Rispetto ai concimi utilizzati nella concimazione chimica tradizionale,in fertirrigazione si utilizzano fertilizzanti in forma cristallina e non granulare (sono quindi più solubili),hanno un maggior titolo (sono quindi più puri) ed hanno di conseguenza un maggiore costo.Inoltre i costituenti chimici sono in forma idrata (anche in questo caso sono più solubili in acqua),non contengono residui insolubili e sono a basso titolo di Sodio e Cloro,entrambe generalmente nocivi alle colture. Per i microelementi si utilizzano fertilizzanti liquidi spesso in forma chelata.Anche se l'EC dei concimi dipende dal quantitativo utilizzato,i valori per 1 grammo sono elencati in tabella.
Rispetto ai concimi utilizzati nella concimazione chimica tradizionale,in fertirrigazione si utilizzano fertilizzanti in forma cristallina e non granulare (sono quindi più solubili),hanno un maggior titolo (sono quindi più puri) ed hanno di conseguenza un maggiore costo.Inoltre i costituenti chimici sono in forma idrata (anche in questo caso sono più solubili in acqua),non contengono residui insolubili e sono a basso titolo di Sodio e Cloro,entrambe generalmente nocivi alle colture. Per i microelementi si utilizzano fertilizzanti liquidi spesso in forma chelata.Anche se l'EC dei concimi dipende dal quantitativo utilizzato,i valori per 1 grammo sono elencati in tabella.I concimi chimici utilizzati in fertirrigazione sono elencati nella tabella sottostante,insieme alle loro caratteristiche chimico-fisiche:

Calcolo della soluzione nutritiva per fertirrigazione
La tecnica della fertirrigazione rappresenta una metodologia di precisione della concimazione e prevede una serie di calcoli,formule e procedure attuate in un determinato ordine rigoroso.
Innanzitutto occorre distinguere tra fertirrigazione in fuori-suolo e in pieno campo. Nel primo caso,per es. in idroponica,è richiesta solo l'analisi dell'acqua irrigua mentre nel secondo caso,quello di interesse più generale e comune,è richiesta anche l'analisi del suolo. Nella fertirrigazione in pieno campo,però,non è strettamente necessario calcolare il fabbisogno di meso e micro-elementi poichè in genere il suolo ne possiede quantità sufficienti.Tuttavia a scopo esemplificativo è comunque possibile una valutazione. Un'altra differenza tra fertirrigazione fuori suolo e in pieno campo consiste nel fatto che nel secondo caso il fabbisogno di elementi nutritivi,come da piano di concimazione e relativamente all'Azoto,Fosforo e Potassio, è espresso in Kg/ha e non in mmoli/L. Ovviamente poi,essendo i concimi distribuiti con l'acqua di irrigazione, è necessario coinvolgere il fabbisogno idrico delle colture che,nella fertirrigazione in pieno campo dipende da diversi parametri inclusi quelli climatici.In ultimo,oltre all'impianto per fertirrigazione occorre considerare anche quello a goccia o con tecnologia simile.
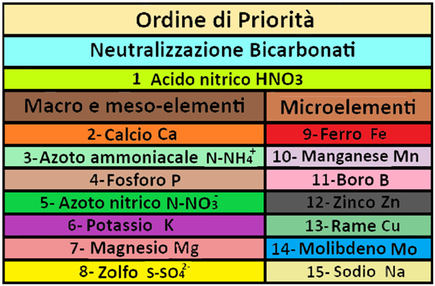 Come accennato,il calcolo dei quantitativi dei concimi da utilizzare per preparare la soluzione nutritiva deve obbligatoriamente seguire un ordine di priorità:si comincia con il calcolare la quantità di un acido necessaria per neutralizzare gran parte dei bicarbonati per poi,nell'ordine,calcolare le quantità di concimi per apportare Calcio,Azoto ammoniacale,Fosforo,Azoto nitrico,Potassio,Magnesio e Zolfo,Ferro,Manganese,Boro,Zinco, Rame e Molibdeno.Tra i macroelementi e mesoelementi Magnesio e Zolfo sono considerati per ultimo poichè anche se in eccesso non provocano tossicità alle colture.Per tale motivo essi sono molto importanti ai fini dei calcoli quando sussiste uno squilibrio di macroelementi nella soluzione nutritiva.Per es,se occorre aumentare il quantitativo di potassio nella soluzione,si può optare sul nitrato potassico o sul solfato potassico.La scelta ricade sul solfato perchè con il nitrato potassico si apporterebbe anche ulteriore Azoto nitrico.Infine il Magnesio e i solfati sono anche sfruttati per pareggiare squilibri ionici.
Come accennato,il calcolo dei quantitativi dei concimi da utilizzare per preparare la soluzione nutritiva deve obbligatoriamente seguire un ordine di priorità:si comincia con il calcolare la quantità di un acido necessaria per neutralizzare gran parte dei bicarbonati per poi,nell'ordine,calcolare le quantità di concimi per apportare Calcio,Azoto ammoniacale,Fosforo,Azoto nitrico,Potassio,Magnesio e Zolfo,Ferro,Manganese,Boro,Zinco, Rame e Molibdeno.Tra i macroelementi e mesoelementi Magnesio e Zolfo sono considerati per ultimo poichè anche se in eccesso non provocano tossicità alle colture.Per tale motivo essi sono molto importanti ai fini dei calcoli quando sussiste uno squilibrio di macroelementi nella soluzione nutritiva.Per es,se occorre aumentare il quantitativo di potassio nella soluzione,si può optare sul nitrato potassico o sul solfato potassico.La scelta ricade sul solfato perchè con il nitrato potassico si apporterebbe anche ulteriore Azoto nitrico.Infine il Magnesio e i solfati sono anche sfruttati per pareggiare squilibri ionici.Nell'ordine di priorità alcuni passaggi sono eliminabili quando nell'acqua e/o nel suolo sono presenti determinato elementi in concentrazione sufficiente ai fabbisogni colturali.
Esempio di Calcolo
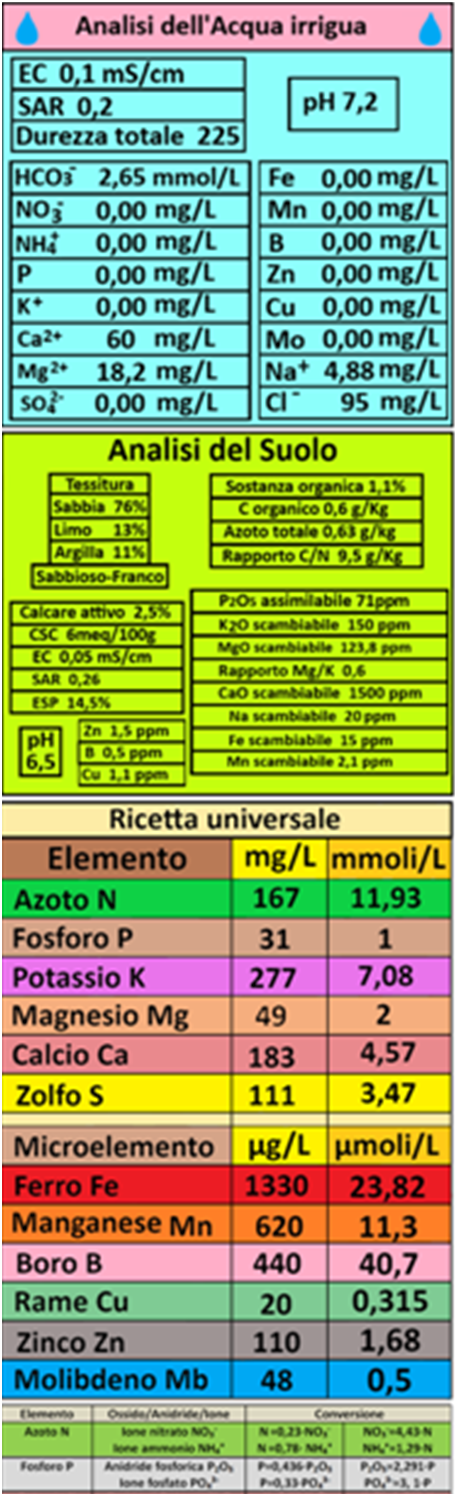 Si consideri di voler concimare per fertirrigazione un appezzamento di 0,5 ettari coltivato a Peperoni.I calcoli da eseguire,in ordine obbligato,sono i seguenti:
Si consideri di voler concimare per fertirrigazione un appezzamento di 0,5 ettari coltivato a Peperoni.I calcoli da eseguire,in ordine obbligato,sono i seguenti:1)Analisi del suolo e dell'acqua - Dal momento che la coltura si trova in pieno campo,occorre conoscere non solo i parametri chimico-fisici dell'acqua d'irrigazione ma anche quelli del suolo.
In questo modo risulta evidente che i nutrienti già presenti nell'acqua e nel suolo devono essere sottratti dai fabbisogni colturali.
Per semplicità si assume che i valori di Azoto,Fosforo e Potassio del suolo siano già stati calcolati così come i loro fabbisogni (vedere fabbisogni colturali più avanti dove si stabilisce che N=418Kg/ha,P2O5 =178Kg/ha,K2O =834,5Kg/ha).
Dall'analisi dell'acqua e del suolo è importante conoscere il valore della Conducibilità elettrica che in questo caso si assume pari a EC=0,05mS/cm per il suolo e EC=0,1mS/cm per l'acqua.La concentrazione dei Bicarbonati nell'acqua si assume pari a 2,65mmoli/L.
2)Impianti utilizzati- Per quanto riguarda l'impianto di fertirrigazione occorre conoscere la Portata Qi degli iniettori della soluzione nutritiva,per es. 50L/ora e il Volume dei serbatoi Vs,per es.200L.Per quanto riguarda l'impianto di irrigazione goccia occorre conoscere la Portata dei singoli gocciolatori Qg(per es 1L/h),la loro distanza sulla linea Dg(per es 0,4m) e tra le linee Dl(per es 1,8m).A questi dati si aggiungono la superficie coltivata(0,5 ettari)e il Volume irriguo totale per l'intero ciclo colturale,per es.6000m3/ha.
3)Fabbisogni colturali - Poichè i concimi per fertirrigazione vengono disciolti in acqua, le loro quantità vengono usualmente espresse in mmoli/L o in mg/L (o loro multipli e sottomultipli). Tuttavia,i fabbisogni di Azoto,Fosforo e Potassio per fertirrigazione in campo vengono generalmente espressi in Kg/ha e si ricavano tramite il Piano di concimazione considerando vari fattori tra i quali la produzione attesa e gli asporti colturali.
Anche se impropriamente,si possono fornire dei valori indicativi adottando le quantità previste dal Sistema della ricetta universale valida per ogni coltura oppure dei valori standard specifici.
Occorre prestare attenzione al fatto che il fabbisogno di Azoto può essere espresso come Azoto N totale oppure distintamente come Azoto nitrico NO3- e come Azoto ammoniacale NH4+(raramente anche a quello ureico); il fabbisogno di Fosforo può essere espresso come elemento P,come P2O5,come PO43-, o come H2PO4-; il fabbisogno di Potassio può essere espresso come K (o meglio K+) o come K2O; il fabbisogno di Zolfo può essere espresso come S, come SO3 o come SO42-;il Boro è a volte considerato come B.A seconda della forma utilizzata possono essere richieste delle conversioni.
Nell'esempio proposto si assume che il fabbisogno di Azoto N sia,come da ricetta universale pari a N=167mg/L=11,93 mmoli/L (di cui 10,93mmoli/L in forma nitrica e 1mmole/l in forma ammoniacale) o, come da piano di concimazione,N=417Kg/ha;il fabbisogno di Fosforo P sia,come da ricetta universale pari a P=31mg/L=1mmole/L o, come da piano di concimazione,P2O5=178Kg/ha;il fabbisogno di Potassio K sia,come da ricetta universale pari a K=277mg/L=7,08mmoli/L o, come da piano di
concimazione,K2O=834Kg/ha.
Come da ricetta universale si assuma anche che il fabbisogno in Calcio sia pari a 183mg/L=4,57mmoli/L e quello di Magnesio pari a 49mg/L=2mmoli/L.
A questo punto i microelementi per la fertirrigazione in pieno campo si possono anche trascurare. Tuttavia si assuma,sempre da ricetta universale, che il fabbisogno di Ferro sia Fe=23,82µmoli/L=1330µg/L;il fabbisogno di Manganese sia Mn=11,3µmoli/L=620µg/L;il fabbisogno di Boro sia B=40,7µmoli/L=440µg/L;il fabbisogno di Zinco sia Zn=1,68µmoli/L=110µg/L;il fabbisogno di Rame sia Cu=0,315µmoli/L=20µg/L e il fabbisogno di Molibdeno sia Mo=0,5µmoli/L=48µg/L.
La Ricetta universale,sebbene non proprio accurata e con valori che possono variare a seconda degli Autori, ha la pregevole caratteristica di poter essere applicata alla coltivazione di diverse orticole evitando complicazioni nella impiantistica per fertirrigazione.
Oltre alla ricetta universale,per calcoli più precisi si può anche consultare la tabella specifica per singole colture orticole:
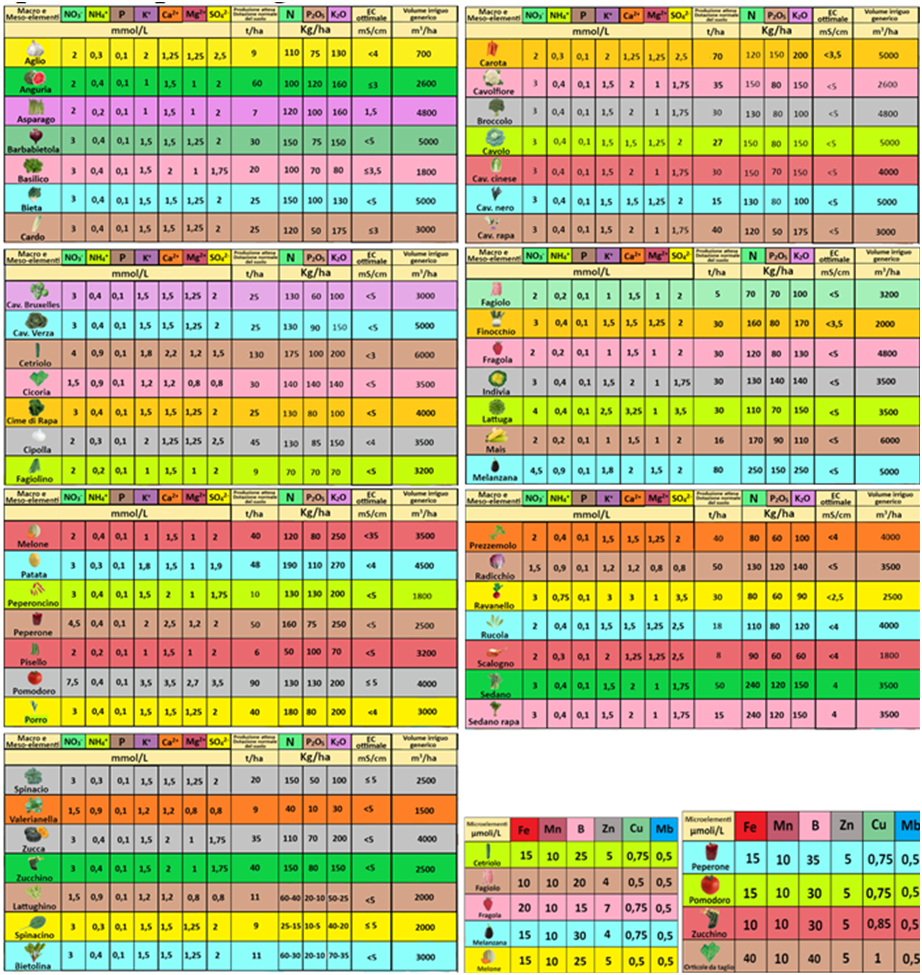
 4)Neutralizzazione dei Bicarbonati - Dall'analisi dell'acqua la quantità di Bicarbonati è pari a 3,11mmol/L.Occorre quindi aggiungere uno o più acidi per neutralizzare i bicarbonati e in modo che la soluzione abbia un valore di pH pari a 6.In pratica la scelta ricade quasi sempre sulla aggiunta di Acido nitrico al 67% (d=1,4g/ml).
4)Neutralizzazione dei Bicarbonati - Dall'analisi dell'acqua la quantità di Bicarbonati è pari a 3,11mmol/L.Occorre quindi aggiungere uno o più acidi per neutralizzare i bicarbonati e in modo che la soluzione abbia un valore di pH pari a 6.In pratica la scelta ricade quasi sempre sulla aggiunta di Acido nitrico al 67% (d=1,4g/ml). [HCO3-]=3,11 mmol/L
[HA] = [HCO3-]/(1+10pH-6,35)
[HNO3]=3,11/(1+106-6,35)=3,11/(1+10-0,35) = 3,11/(1+0,447)= 3,11/1,447=2,15 mmol/L
Q = [HA] • PE / (10 •d • T)
Q = (2,15*63)/(10*1,4*67) = 135,45/938= 0,14 ml/L
oppure mmoli HNO3*PM*100/T%=2,15*63*100/67=202,16mg/L di HNO3 al 67%
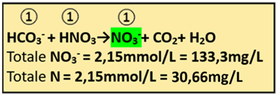
Oltre a neutralizzare parte dei bicarbonati,l'Acido nitrico apporta anche Azoto nitrico
Il rapporto stechiometrico tra Acido nitrico e Ione nitrato è pari a 1:1 e quindi:
1:1=2,68:x x=2,15mmol/L NO3-
2,15mmol/L*62=133,3mg/LNO3-
N=0,23*NO3-=0,23*133,3=30,66mg/L
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Azoto in Kg/ha
30,66mg/L*0,000001*2500/0,001=76,6Kg/ha di N
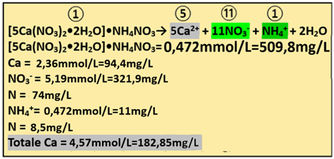 5)Apporto di Calcio - I concimi utilizzati per apportare Calcio sono rappresentati da Nitrato di Calcio agricolo [5Ca(NO3)2 • 2H2O]•NH4NO3(p.m. 1080) e Cloruro di calcio. Si utilizza il primo poichè il secondo apporta anche cloro. Dall'analisi dell'acqua risulta che il Calcio è presente con concentrazione pari a 60mg/L,cioè 60/PM(40,01)=1,5mmoli/L mentre dall’analisi del suolo risulta che è presente come CaO con concentrazione pari a 40 ppm.
5)Apporto di Calcio - I concimi utilizzati per apportare Calcio sono rappresentati da Nitrato di Calcio agricolo [5Ca(NO3)2 • 2H2O]•NH4NO3(p.m. 1080) e Cloruro di calcio. Si utilizza il primo poichè il secondo apporta anche cloro. Dall'analisi dell'acqua risulta che il Calcio è presente con concentrazione pari a 60mg/L,cioè 60/PM(40,01)=1,5mmoli/L mentre dall’analisi del suolo risulta che è presente come CaO con concentrazione pari a 40 ppm.CaO=40ppm=40mg/L Ca=0,715*CaO=0,715*40=28,6mg/L 28,6/40,01=0,71mmol/L
Il fabbisogno per la coltura è pari a 4,57mmol/L e di conseguenza
Fabbisogno netto=Ca in soluzione nutritiva–(Ca in acqua+Ca nel suolo)=4,57-(1,5+0,71)=2,36mmol/L
Il rapporto stechiometrico tra Calce agricola e ioni Calcio è pari a 1:5 e quindi
1:5=x:2,36 x=(2,36*1)/5=0,472mmol/L di Calce agricola
e cioè (mmol/L)*PM=0,472*1080=509,8mg/L di Calce agricola=509,8g/m3
Il rapporto stechiometrico tra Calce agricola e ioni Calcio è pari a 1:5 e quindi
1:5=0,472:x x=(5*0,472)/1=2,36mmol/L di Ca e cioè 2,36*40,01=94,4mg/Ldi Ca
che equivale a 94,4mg/L*1,399=132,1mg/L CaO
Totale Calcio fornito = 1,5+0,71+2,36=4,57mmol/L
La Calce agricola apporta anche Azoto nitrico e ammoniacale.
Il rapporto stechiometrico tra Calce agricola e Ioni nitrato è pari a 1:11 e quindi
1:11=0,472:x=(11*0,472)/1=5,19mmol/L di NO3-
che equivale a 5,19*62=321,9mg/L di NO3 e 321,9*0,23=74mg/L di N
Il rapporto stechiometrico tra Calce agricola e Ioni ammonio è pari a 1:1 e quindi
1:1=0,472:x=(1*0,472)/1=0,472mmol/L di NH4+
che equivale a 0,472*18=11mg/L di NH4 e 11*0,78=8,5mg/L di N
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Azoto in Kg/ha
74mg/L*0,000001*2500/0,001=185Kg/ha di N
8,5mg/L*0,000001*2500/0,001=21,25Kg/ha di N
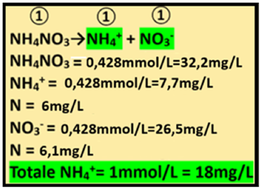 6)Apporto di Azoto ammoniacale - Oltre alla Calce agricola,i concimi che apportano Azoto ammoniacale sono rappresentati da Nitrato ammonico,Solfato ammonico,Fosfato ammonico e biammonico.Si utilizza il Nitrato ammonico NH4NO3 (PM=80) che è poco costoso,apporta anche Azoto nitrico e non apporta fosforo che deve essere considerato solo in seguito.
6)Apporto di Azoto ammoniacale - Oltre alla Calce agricola,i concimi che apportano Azoto ammoniacale sono rappresentati da Nitrato ammonico,Solfato ammonico,Fosfato ammonico e biammonico.Si utilizza il Nitrato ammonico NH4NO3 (PM=80) che è poco costoso,apporta anche Azoto nitrico e non apporta fosforo che deve essere considerato solo in seguito.Dall'analisi dell'acqua risulta che l'Azoto ammoniacale non è presente mentre nel suolo è presente con una concentrazione pari 1,8ppm.
NH4+=1,8ppm=1,8mg/L 1,8/PM=1,8/18=0,1mmol/L
Il fabbisogno per la coltura è pari a 1mmol/L a cui sottrarre gli apporti precedenti e del terreno e di conseguenza:
Fabbisogno netto=NH4+ in soluzione nutritiva-(NH4+ in acqua+NH4+ nel suolo+NH4+ apporti precedenti)= 1-(0+0,1+0,472)=0,428mmol/L
Il rapporto stechiometrico tra Nitrato ammonico e ioni ammonio è pari a 1:1 e quindi1:1 e quindi
1:1=x:0, 428 x=(0,428*1)/1=0,428mmol/L di Nitrato ammonico
e cioè (mmol/L)*PM=0,428mmol/L*80=32,2mg/L di Nitrato ammonico=32,2g/m3
Analogamente 1:1=0,428:x x=(1*0,428)/1= 0,428mmol/L di NH4+
che equivale a 0,428*18=7,7mg/L di NH4 e 7,7mg/L*0,78=6mg/L N
Totale Azoto ammoniacale fornito = 0,472+0,428+0,1=1mmol/L
Il Nitrato ammonico apporta anche Azoto nitrico.
Il rapporto stechiometrico tra Nitrato ammonico e ioni nitrato è pari a 1:1 e quindi 1:1=x:0,428 x=(0,428*1)/1=0,428mmol/L di NO3-
e cioè 0,428mmol/L*62=26,5mg/L NO3 =26,5*0,23=6,1mg/L di N
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Azoto in Kg/ha
6mg/L*0,000001*2500/0,001=15Kg/ha di N
6,1mg/L*0,000001*2500/0,001=15,15Kg/ha di N
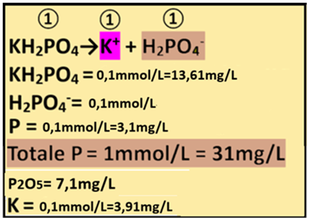 7) Apporto di Fosforo - I concimi che apportano Fosforo sono rappresentati da Fosfato monopotassico e bipotassico,Fosfato ammonico e biammonico.Si utilizza il Fosfato monopotassico KH2PO4 (PM=136,1) che non apporta ulteriore Azoto ammoniacale.
7) Apporto di Fosforo - I concimi che apportano Fosforo sono rappresentati da Fosfato monopotassico e bipotassico,Fosfato ammonico e biammonico.Si utilizza il Fosfato monopotassico KH2PO4 (PM=136,1) che non apporta ulteriore Azoto ammoniacale.Dall'analisi dell'acqua risulta che il Fosforo non è presente mentre dall’analisi del suolo risulta che è presente come P2O5 con concentrazione pari a 65 ppm.
P2O5=65ppm=65mg/L P=0,436*P2O5=0,436*65=28,34mg/L P=28,34/31=0,9mmol/L
Il fabbisogno per la coltura è pari a 1mmol/L e quindi
Fabbisogno netto=P in soluzione nutritiva–(P in acqua+P nel suolo)=1-(0+0,9)=0,1mmol/L
Il rapporto stechiometrico tra Fosfato monopotassico e Fosforo P è pari a 1:1 e quindi
1:1=x:1 x=(1*0,1)/1=0,1mmol/L di Fosfato monopotassico e cioè (mmol/L)*PM=0,1*136,1=13,61mg/L di Fosfato monopotassico=13,61g/m3
Il rapporto stechiometrico tra Fosfato monopotassico e Fosforo P è pari a 1:1 e quindi
1:1=x:0,1 x=(1*0,1)/1=0,1mmol/L di Fosforo e cioè P=0,1*31=3,1mg/L
che equivale a 3,1mg/L*2,291=7,1mg/L P2O5
Totale Fosforo P fornito = 0+0,9+0,1=1mmol/L
Il Fosfato monopotassico apporta anche Potassio K.
Il rapporto stechiometrico tra Fosfato monopotassico e ioni potassio è pari a 1:1 e quindi
1:1=1:x=(0,1*1)/1=0,1mmol/L di K e cioè 0,1*39,1=3,91mg/L di K
che equivale a 3,91mg/L*1,205=4,71mg/L K2O
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Fosforo come P2O5 e di Potassio come K2O in Kg/ha
P2O5 =7,1mg/L=71*0,000001*2500/0,001=17,8kg/ha
K2O=4,71mg/L=47,1*0,000001*2500/0,001=11,8kg/ha
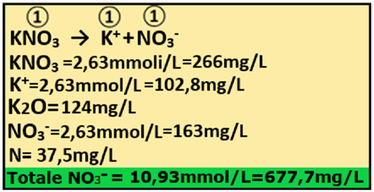 8)Apporto di Azoto nitrico - I concimi che apportano Azoto nitrico,oltre all'Acido nitrico, il Nitrato ammonico,il Nitrato di calcio, sono rappresentati dal Nitrato potassico e dal Nitrato di magnesio.Si utilizza il Nitrato potassico KNO3 (PM=101,1).
8)Apporto di Azoto nitrico - I concimi che apportano Azoto nitrico,oltre all'Acido nitrico, il Nitrato ammonico,il Nitrato di calcio, sono rappresentati dal Nitrato potassico e dal Nitrato di magnesio.Si utilizza il Nitrato potassico KNO3 (PM=101,1).Dall'analisi dell'acqua risulta che l'Azoto nitrico non è presente mentre dall’analisi del suolo risulta che è con concentrazione pari a 32,86 ppm.
NO3-=32,86 ppm=32,86mg/L 32,86/PM=32,86/62=0,53mmol/L
Il fabbisogno per la coltura è pari a 10,93mmol/L a cui sottrarre gli apporti precedenti e del terreno e di conseguenza di conseguenza
Fabbisogno netto=NO3- in soluzione nutritiva-(NO3- in acqua+NO3-nel suolo+NO3- apporti precedenti) =10,93-(0+0,53+2,15+5,19+0,428)= 10,93-8,3=2,63mmoli/L
e cioè (mmol/L)*PM=2,63*101,1=266mg/L di Nitrato potassico=266g/m3
Il rapporto stechiometrico tra Nitrato potassico e Azoto nitrico è pari a 1:1 e quindi
1:1=2,63:x=(1*2,63)/1=2,63mmol/L di NO3-
che equivale a 2,63*62=163mg/L di NO3 e 163*0,23=37,5mg/L di N
Totale azoto nitrico fornito =2,68+5,19+0,428+2,63=10,93/L
Il Nitrato potassico apporta anche Potassio K.
Il rapporto stechiometrico tra Nitrato potassico e ioni potassio è pari a 1:1 e quindi
1:1=2,63:x x=(1*2,63)/1=2,63mmol/L di K e cioè (mmol/L)*PM=2,63*39,1=102,8mg/L di K
che equivale a 102,8mg/L*1,205=124mg/L K2O
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Azoto N e di Potassio come K2O in Kg/ha
N=37,5mg/L*0,000001*2500/0,001=93,8kg/ha
K2O=124mg/L*0,000001*2500/0,001=310Kg/ha
 9)Apporto di Potassio - I concimi che apportano Potassio,oltre al Fosfato e al Nitrato di Potassio,il Nitrato ammonico,il Nitrato di calcio,sono rappresentati dal Solfato potassico e dal Cloruro di potassio.Si utilizza il Solfato potassico (PM=174,2)poichè il secondo apporta anche cloro.
9)Apporto di Potassio - I concimi che apportano Potassio,oltre al Fosfato e al Nitrato di Potassio,il Nitrato ammonico,il Nitrato di calcio,sono rappresentati dal Solfato potassico e dal Cloruro di potassio.Si utilizza il Solfato potassico (PM=174,2)poichè il secondo apporta anche cloro.Dall'analisi dell'acqua risulta che il Potassio non è presente mentre dall’analisi del suolo risulta che è presente come K2O con concentrazione pari a 150 ppm.
K2O=150ppm=150mg/L K=0,83*K2O =0,83*150=124,5mg/L 124,5/39,1=3,18 mmol/L
Il fabbisogno per la coltura è pari a 7,08mmol/L a cui sottrarre gli apporti precedenti e di conseguenza Fabbisogno netto=K nella soluzione nutritiva-(K in acqua+K nel suolo+K apporti precedenti) =7,08-(0+3,18+0,1+2,63)=1,17mmoli/L
Il rapporto stechiometrico tra Solfato potassico e Potassio è pari a 1:2 e quindi
1:2=x:1,17 x=(1,17*1)/2=0,585 mmol/L di Solfato potassico
e cioè (mmol/L)*PM=0,585*174,2=102mg/L di Solfato potassico=102g/m3
Il rapporto stechiometrico tra Solfato potassico e Potassio è pari a 1:2 e quindi
1:2=0,585:x x=(2*0,585)/1=1,17 mmol/L di di K e cioè 1,17*39,1=45,7mg/L di K
che equivale a 45,7*1,205=55mg/L di K2O
Totale Potassio fornito = 0,1+3,18+2,63+1,17=7,08mmol/L
Il Nitrato potassico apporta anche Zolfo S.
Il rapporto stechiometrico tra Solfato potassico e Ione solfato è pari a 1:1 e quindi
1:1=0,585 :x x=(1*0,585 )/1=0,585 mmol/L di di SO4 e cioè (mmol/L)*PM=0,585 *96=56,16mg/L di SO4
che equivale a 56,16*0,33=18,5mg/L di S
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Potassio come K2O e di Zolfo S in Kg/ha
K2O=55mg/L*0,000001*2500/0,001=137,5kg/ha
S=18,5mg/L*0,000001*2500/0,001=46,3kg/ha
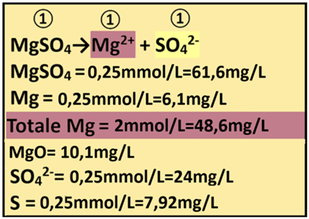 10) Apporto di Magnesio - I concimi che apportano Magnesio sono rappresentati da Magnesio solfato eptaidrato e Magnesio nitrato. Si utilizza il Magnesio solfato eptaidrato (PM=246,3) poichè il secondo apporta anche Azoto nitrico che però è già stato completato.
10) Apporto di Magnesio - I concimi che apportano Magnesio sono rappresentati da Magnesio solfato eptaidrato e Magnesio nitrato. Si utilizza il Magnesio solfato eptaidrato (PM=246,3) poichè il secondo apporta anche Azoto nitrico che però è già stato completato.Dall'analisi dell'acqua risulta che il Magnesio è presente con concentrazione pari a 18,2mg/L cioè 18,2/PM(24,3)=0,75 mmol/L mentre dall’analisi del suolo risulta che è presente come MgO con concentrazione pari a 123,8 ppm.
MgO =40 ppm=40 mg/L Mg=0,603*MgO =0,603*40 =24,12 mg/L 24,12/24,3=1mmol/L
Il fabbisogno per la coltura è pari a 2mmol/L a cui sottrarre l'apporto nell'acqua e di conseguenza
Fabbisogno netto=Concentrazione nella soluzione nutritiva-(Mg in acqua+Mg nel suolo+Mg apporti precedenti)=2-(0+0,75+1)=0,25 mmoli/L
Il rapporto stechiometrico tra Magnesio solfato e Magnesio è pari a 1:1 e quindi
1:1=x: 0,25 x=(0,25 *1)/1=0,25 mmol/L di Magnesio solfato
e cioè (mmol/L)*PM=0,25 *246,3=61,6mg/L di Magnesio solfato=61,6g/m3
Il rapporto stechiometrico tra Magnesio solfato e Magnesio è pari a 1:1 e quindi
1:1=x: 0,25 x=(0,25 *1)/1=0,25mmol/L di Mg e cioè 0,25*24,3=6,1mg/L di Mg
che equivale a 6,1*1,658=10,1mg/L di MgO
Totale Magnesio fornito = 0,75+1+0,25=2mmol/L
Il Magnesio solfato apporta anche Zolfo S.
Il rapporto stechiometrico tra Magnesio solfato e Ione solfato è pari a 1:1 e quindi
1:1=0,25:x x=(1*0,25)/1=0,25 mmol/L di di SO4 e cioè (mmol/L)*PM = 0,25*96=24mg/L di SO4
che equivale a 24*0,33=7,92mg/L di S
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Magnesio come MgO in Kg/ha
MgO=6,1mg/L=6,1*0,000001*2500/0,001=15,3kg/ha
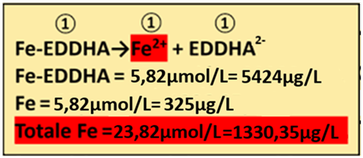 11) Apporto di Ferro - I concimi che apportano Ferro sono rappresentati da Ferro chelato e Ferro solfato. Si utilizza il Ferro chelato con EDDHA (PM=932) poichè il secondo apporta anche Zolfo ed è in forma solida e non liquida.
11) Apporto di Ferro - I concimi che apportano Ferro sono rappresentati da Ferro chelato e Ferro solfato. Si utilizza il Ferro chelato con EDDHA (PM=932) poichè il secondo apporta anche Zolfo ed è in forma solida e non liquida.Dall'analisi dell'acqua risulta che il Ferro non è presente mentre dall’analisi del suolo risulta che è presente con concentrazione pari a 1 ppm.
Fe=1 ppm=1 mg/L 1/55,85=0,018mmol/L=18 μmol/L
Il fabbisogno per la coltura è pari a 23,82μmol/L a cui e di conseguenza
Fabbisogno netto=Fe in soluzione nutritiva(Fe in acqua+Fe nel suolo)=23,82-(0+18)=5,82 μmoli/L
Il rapporto stechiometrico tra Fe-EDDHA e Ferro è pari a 1:1 e quindi
1:1=x: 5,82 x=(5,82 *1)/1=5,82μmol/L di Fe-EDDHA
e cioè (μmol/L)*PM=5,82 *932=5424μg/L di Fe-EDDHA=0,005424g/m3
Il rapporto stechiometrico tra Fe-EDDHA e Ferro è pari a 1:1 e quindi
1:1=x:5,82 x=(5,82*1)/1=5,82μmol/L di Fe e cioè 5,82*55,85=325μg/L di Fe
Totale Ferro fornito = 18+5,82=23,82μmol/L =1330,35μg/L
Il Magnesio solfato apporta anche l'agente chelante EDDHA.
Il rapporto stechiometrico tra Fe-EDDHA e EDDHA è pari a 1:1 e quindi
1:1=5,82:x x=(1*5,82)/1=5,82 mmol/L di di EDDHA
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Ferro in Kg/ha
Fe=325μg/L=0,325mg/L=0,325*0,000001*2500/0,001=0,8kg/ha
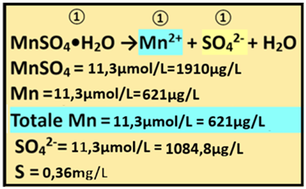 12) Apporto di Manganese - Il concime che apporta Manganese è rappresentato da Manganese solfato monoidrato (PM=169).
12) Apporto di Manganese - Il concime che apporta Manganese è rappresentato da Manganese solfato monoidrato (PM=169).Dall'analisi dell'acqua risulta che il Manganese non è presente.Il fabbisogno per la coltura è pari a 11,3μmol/L e di conseguenza
Fabbisogno netto=Concentrazione nella soluzione nutritiva=11,3-0=11,3μmol/L
Il rapporto stechiometrico tra Manganese solfato e Manganese è pari a 1:1 e quindi 1:1=x:11,3 x=(11,3*1)/1=11,3μmol/L di Manganese solfato
e cioè (μmol/L)*PM=11,3*169=1910μg/L di Manganese solfato=0,00191g/m3
Il rapporto stechiometrico tra Manganese solfato e Manganese è pari a 1:1 e quindi 1:1=x:11,3 x=(11,3*1)/1=11,3μmol/L di Mn e cioè 11,3*54,94=621μg/L di Mn
TotaleManganesefornito =11,3μmol/L
Il Manganese solfato apporta anche Zolfo S.
Il rapporto stechiometrico tra Manganese solfato e Ione solfato è pari a 1:1 e quindi 1:1=11,3:x x=(1*11,3)/1=11,3μmol/L di SO4 e cioè (μmol/L)*PM=11,3*96=1084,8μg/L di SO4 =1,085mg/L di SO4
che equivale a 1,085*0,33=0,36mg/L di S
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Manganese in Kg/ha
Mn=621μg/L=0,621mg/L=0,621*0,000001*2500/0,001=1,5kg/ha
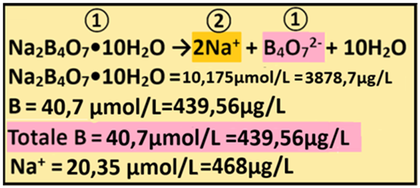 13)Apporto di Boro - I concimi che apportano Boro sono rappresentati da Borace (PM=381,2) e Acido borico,ma il più utilizzato è il primo.Dall'analisi dell'acqua risulta che il Boro non è presente.Il fabbisogno per la coltura è pari a 40,7μmol/L e di conseguenza Fabbisogno netto=Concentrazione nella soluzione nutritiva=40,7-0= 40,7μmol/L
13)Apporto di Boro - I concimi che apportano Boro sono rappresentati da Borace (PM=381,2) e Acido borico,ma il più utilizzato è il primo.Dall'analisi dell'acqua risulta che il Boro non è presente.Il fabbisogno per la coltura è pari a 40,7μmol/L e di conseguenza Fabbisogno netto=Concentrazione nella soluzione nutritiva=40,7-0= 40,7μmol/LIl rapporto stechiometrico tra Boro e ione Borato è pari a 4:1 e quindi 4:1=40,7:x x=(40,7*1)/4=10,175 μmol/L di ione borato
Il rapporto stechiometrico tra ione Borato e Borace è pari a 1:1 e quindi 1:1=10,175:x x=(10,175*1)/1= 10,175μmol/L di Borace
e cioè (μmol/L)*PM=10,175*381,2=3878,7μg/L di Borace=0,003878g/m3
Il rapporto stechiometrico tra Borace e Boro è pari a 1:4 e quindi 1:4=10,175:x x=(4*10,175)/1=40,7 μmol/L di B e cioè 40,7*10,8=439,56μg/L di B
Totale Boro fornito =40,7μmol/L
Il rapporto stechiometrico tra Borace e Ione tetraborato è pari a 1:1 e quindi
1:1=10,175:x x=10,175μmol/L di B4O72-
Il Borace apporta anche Sodio Na.
Il rapporto stechiometrico tra Borace e Sodio è pari a 1:2 e quindi 1:2=10,2:x x=(2*10,175)/1=20,35 μmol/L di Na e cioè (μmol/L)*PM = 20,35*23=468μg/L di Na
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Boro in Kg/ha
B=40,7μg/L=0,0407mg/L=0,0407*0,000001*2500/0,001=0,1kg/ha=102g/ha
 14) Apporto di Zinco - Il concime che apporta Zinco è rappresentato da Zinco solfato eptaidrato (PM=287,5).
14) Apporto di Zinco - Il concime che apporta Zinco è rappresentato da Zinco solfato eptaidrato (PM=287,5).Dall'analisi dell'acqua risulta che lo Zinco non è presente.Il fabbisogno per la coltura è pari a 1,68μmol/L e di conseguenza
Fabbisogno netto=Concentrazione nella soluzione nutritiva=1,68-0=1,68μmol/L
Il rapporto stechiometrico tra Zinco solfato e Zinco è pari a 1:1 e quindi 1:1=x:1,68 x=(1,68*1)/1=1,68μmol/L di Zinco solfato e cioè (μmol/L)*PM=1,68*287,5=483μg/L di Zinco solfato =0,000483g/m3
Il rapporto stechiometrico tra Zinco solfato e Zinco è pari a 1:1 e quindi 1:1=x:1,68 x=(1,68*1)/1=1,68μmol/L di Zn e cioè 1,68*65,38=110μg/L di Zn
TotaleZincofornito =1,68μmol/L
Lo Zinco solfato apporta anche Zolfo S.
Il rapporto stechiometrico tra Zinco solfato e Ione solfato pari a 1:1 e quindi 1:1=1,68:x x=(1*1,68)/1=1,68μmol/L di SO4 e cioè (μmol/L)*PM = 1,68*96=161,3μg/L di SO4=0,16mg/L di SO4
che equivale a 0,16*0,33=0,05mg/L di S
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Zinco in Kg/ha
Zn=110μg/L=0,11mg/L=0,11*0,000001*2500/0,001=0,275kg/ha=275g/ha
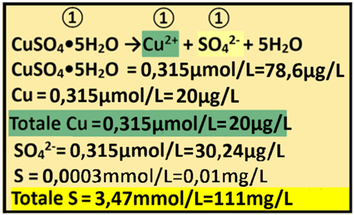 15) Apporto di Rame - Il concime che apporta Rame è rappresentato da Rame solfato pentaidrato (PM=249,7).
15) Apporto di Rame - Il concime che apporta Rame è rappresentato da Rame solfato pentaidrato (PM=249,7).Dall'analisi dell'acqua risulta che il Rame non è presente.Il fabbisogno per la coltura è pari a 0,315μmol/L e di conseguenza
Fabbisogno netto=Concentrazione nella soluzione nutritiva=0,315-0=0,315μmol/L
Il rapporto stechiometrico tra Rame solfato pentaidratoe Rame è pari a 1:1 e quindi 1:1=x:0,315 x=(1*0,315)/1=0,315μmol/L di Rame solfato pentaidrato e cioè (μmol/L)*PM=0,315*249,7 =78,6μg/L di Rame solfato pentaidrato=0,0000786g/m3
Il rapporto stechiometrico tra Rame solfato pentaidrato e Rame è pari a 1:1 e quindi 1:1=x:0,315 x=(1*0,315)/1=0,315μmol/L di Cu e cioè 0,315*63,55=20μg/L di Cu
Totale Rame fornito =0,315μmol/L
Il Rame solfato pentaidrato apporta anche Zolfo S.
Il rapporto stechiometrico tra Rame solfato pentaidrato e Ione solfato è pari a 1:1 e quindi
1:1=0,315:x x=(1*0,315)/1=0,315μmol/L di SO4 e cioè (μmol/L)*PM = 0,315*96=30,24μg/L di SO4 =0,03mg/L di SO4
che equivale a 0,03*0,33=0,01mg/L di S
Totale Ione solfato SO4fornito =(2,65+0,585+0,25)mmol/L+(11,3+1,68+0,315)μmol/L= 3,485+0,013 =3,5mmol/L e cioè (mmol/L)*PM=3,5*96=336mg/L che equivale a 336*0,33=111mg/L di S
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Rame in Kg/ha
Cu=20μg/L=0,02mg/L=0,02*0,000001*2500/0,001=0,05kg/ha=50g/ha
 16) Apporto di Molibdeno - I concimi che apportano Molibdeno sono rappresentati dal Molibdato sodico diidrato (PM=242) e Molibdato ammonico.Si utilizza il Molibdato sodico diidrato poichè il secondo apporta anche Azoto ammoniacale che è già stato bilanciato.
16) Apporto di Molibdeno - I concimi che apportano Molibdeno sono rappresentati dal Molibdato sodico diidrato (PM=242) e Molibdato ammonico.Si utilizza il Molibdato sodico diidrato poichè il secondo apporta anche Azoto ammoniacale che è già stato bilanciato.Dall'analisi dell'acqua risulta che il Molibdeno non è presente.Il fabbisogno per la coltura è pari a 0,5μmol/L e di conseguenza
Fabbisogno netto=Concentrazione nella soluzione nutritiva=0,5-0=0,5μmol/L
Il rapporto stechiometrico tra Molibdato sodico diidrato e Molibdeno è pari a 1:1 e quindi 1:1=x:0,5 x=(0,5*1)/1=0,5μmol/L di Molibdato sodico diidrato e cioè (μmol/L)*PM=0,5*242=121μg/L di Molibdato sodico diidrato=0,0001215424g/m3
Il rapporto stechiometrico tra Molibdato sodico diidrato e Molibdeno è pari a 1:1 e quindi 1:1=x:0,5 x=(0,5*1)/1=0,5μmol/L di Mo e cioè 0,5*95,96=48μg/L di Mo
Totale Molibdeno fornito =0,5μmol/L
Il rapporto stechiometrico tra Molibdato sodico diidrato e Ione molibdato è pari a 1:1 e quindi
1:1=0,5:x x=0,5μmol/L di MoO42-
Il Molibdato sodico diidrato apporta anche Sodio Na.
Il rapporto stechiometrico tra Molibdato sodico diidrato e Sodio è pari a 1:2 e quindi
1:2=0,5:x x=(0,5*2)/1=1 μmol/L di Na e cioè (μmol/L)*PM = 1*23=23μg/L di Na
Totale Sodio fornito = 20,35+1=21,35μmol/L=491,05μg/L
Conoscendo il Volume irriguo totale(2500m3/ha),si può anche calcolare l'apporto di Molibdeno in Kg/ha
Mo=48μg/L=0,048mg/L=0,048*0,000001*2500/0,001=0,12kg/ha=120g/ha
Eseguiti tutti i calcoli si può redigere una tabella riassuntiva:
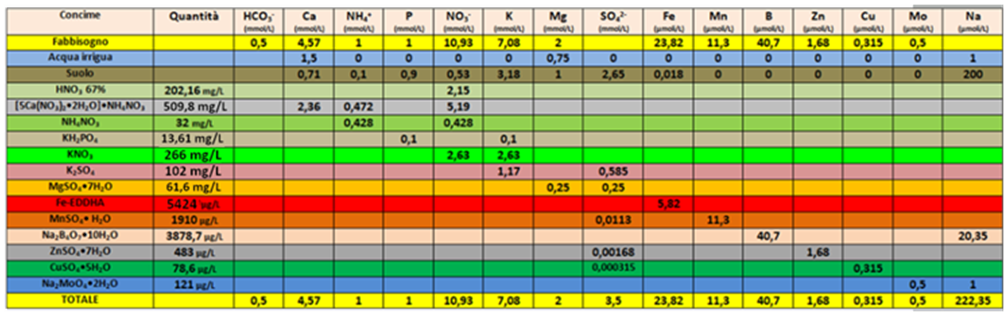
Come si può notare,i valori totali finali rispecchiano fedelmente i fabbisogni colturali. Nella pratica però la redazione del piani di fertirrigazione è reso più complicato rispetto a quello delle tecniche fuori-suolo,poichè oltre al suolo occorre considerare altri fattori che possono variare frequentemente.La tessitura del suolo influisce sull'assorbimento e dilavamento della soluzione nutritiva;l'apporto di concimi organici influisce sulle quantità di concimi chimici da distribuire;nella stagione calda è opportuno ridurre l'EC e il Potassio e contemporaneamente aumentare il Calcio;con quantità elevate di Sodio nel suolo e/o nell'acqua,è opportuno aumentare l'Azoto nitrico e il Calcio e dimimuire il Potassio.
Ne deriva quindi che per la fertirrigazione in campo occorre valutare ed eventualmente rendere compatibile la composizione della soluzione nutritiva con le varie situazioni in cui si trova.
Preparazione della soluzione nutritiva e Giornata fertirrigua
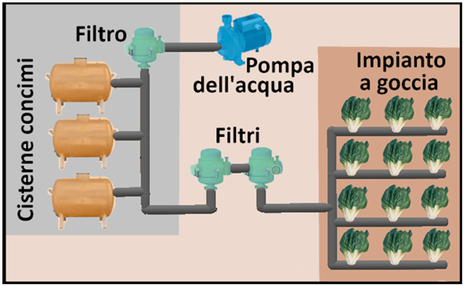
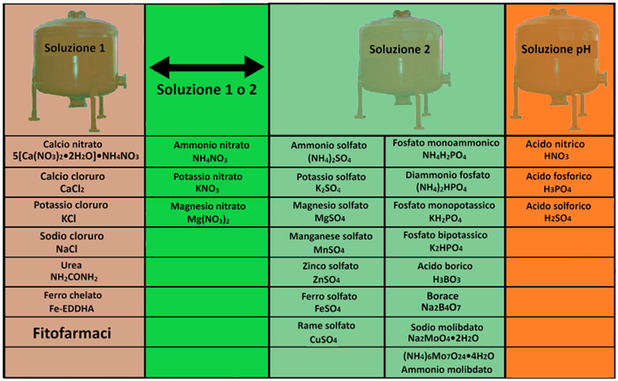 Al fine di evitare reazioni di precipitazione tra i diversi concimi e per poter apportare eventuali correzioni di pH ed EC si preparano 3 distinte soluzioni in 3 cisterne. Come descritto in tabella nel Serbatoio 1 si introducono i nitrati e i chelati, nel Serbatoio 2 i solfati,i fosfati e i microelementi e nel Serbatoio 3 gli acidi.Eventuali fitofarmaci si introducono nella prima soluzione prestando attenzione alla compatibilità.Alcuni concimi si possono introdurre indifferentemente nella prima o seconda soluzione. L'impianto di fertirrigazione,tramite degli iniettori,provvederà poi a miscelare le tre soluzioni nei quantitativi opportuni.
Al fine di evitare reazioni di precipitazione tra i diversi concimi e per poter apportare eventuali correzioni di pH ed EC si preparano 3 distinte soluzioni in 3 cisterne. Come descritto in tabella nel Serbatoio 1 si introducono i nitrati e i chelati, nel Serbatoio 2 i solfati,i fosfati e i microelementi e nel Serbatoio 3 gli acidi.Eventuali fitofarmaci si introducono nella prima soluzione prestando attenzione alla compatibilità.Alcuni concimi si possono introdurre indifferentemente nella prima o seconda soluzione. L'impianto di fertirrigazione,tramite degli iniettori,provvederà poi a miscelare le tre soluzioni nei quantitativi opportuni.I concimi per fertirrigazione vengono distribuiti alle colture tramite irrigazione a goccia di cui occorre conoscere alcuni parametri.Inoltre le loro quantità sono espresse in mg/L o in μg/L e ma le soluzioni nutritive vengono preparate in modo da ottenere volumi superiori ad un solo litro,in base anche alla capacità dei serbatoi che in genere sono di 80,120,150, 200,300,500 o 1000L. La soluzione nutritiva contenuta nel serbatoio è definita Soluzione madre o stock, mentre quella in uscita,diluita con acqua è definita Soluzione figlia.
 Si supponga,dopo aver calcolato i fabbisogni dei vari elementi nutritivi,di avere a disposizione i seguenti dati:
Si supponga,dopo aver calcolato i fabbisogni dei vari elementi nutritivi,di avere a disposizione i seguenti dati:1)Superficie coltivata (Settore) S=1ha=10000m2
2)Dati colturali
-Coltura:Peperone
-Ciclo colturale:120 giorni=4 mesi
-Fabbisogno idrico V=2,083mm/giorno=2,08*120=250mm/ciclo colturale=2500m3/ciclo colturale
3)Dati dell'impianto a goccia
-Distanza tra le linee dei gocciolatori D=1,5m
-Distanza sulla linea(Passo)dei gocciolatori d=40cm=0,4m
-Portata del singolo gocciolatore Qg=1,2L/ora
-Efficienza:85%
-Conversione: 1mm=10m3
4)Dati dell'impianto di fertirrigazione
-Volume dei serbatoi Vs=1m3=1000L
-Portata di iniezione Qi=80L/h
5)dati climatici
-Evapotraspirazione ETc=5,5mm/giorno
Per calcolare i quantitativi di fertilizzanti da sciogliere nei serbatoi per ottenere la soluzione madre occorre prima di tutto considerare un Fattore di concentrazione FC:
FC=(S*Qg)/(D*d*Qi)=(10000*1,2)/(1,5*0,4*150)=133
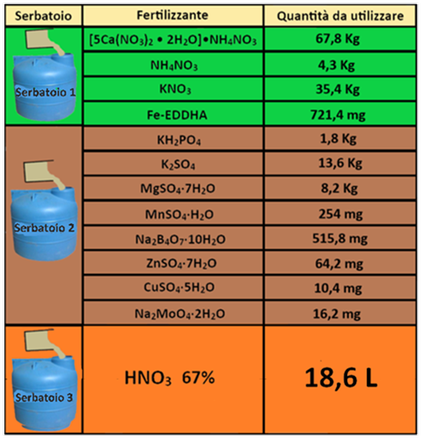
Nel caso dell'Acido nitrico(0,14 ml/L=140ml/m3):
L HNO3=FC*0,000001*Vs*HNO3=133*0,000001*1000*140=18,6L
Nel caso di Potassio nitrato (266mg/L):
Kg KNO3=FC*0,000001*Vs*KNO3=133*0,000001*1000*266=35,4Kg
Gli stessi calcoli si effettuano per tutti gli altri fertilizzanti.
Si può inoltre definire il tempo intercorrente tra una fertirrigazione e l'altra(Turno) e la durata dell'intervento:
Turno T=V/ETc=2,083/2,5=1g tra una irrigazione e l'altra.
Volume irriguo effettivo Vi=(V/Ea)*100=(2,083/85)*100=2,45mm
Intensità di applicazione IA=Qg/D*d=1,2*/1,5*0,4=2mm/ora
Orario O=Vi/IA=2,45/2=1,23ore=1ora14minuti
Quindi si esegue la fertirrigazione tutti i giorni per 1ora14minuti e per 4 mesi.
Tempi di intervento fertirriguo
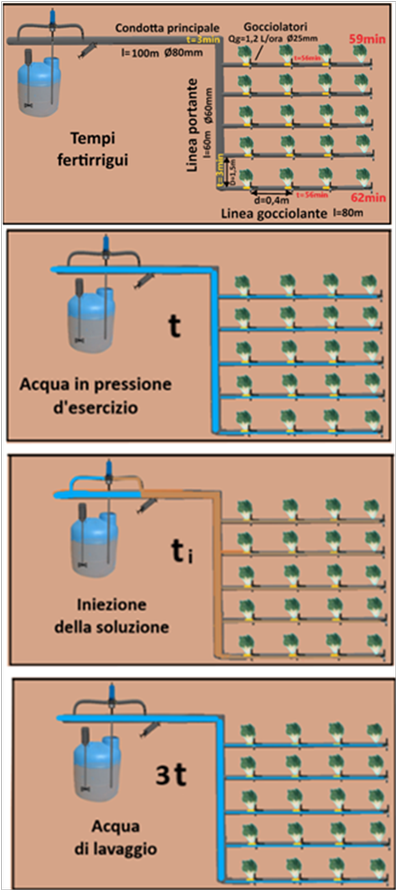 L'Orario O esprime il valore della durata d'intervento fertirriguo.Tuttavia la soluzione nutritiva raggiunge i gocciolatori in tempi diversi.Occorrerebbe quindi tenere conto di ulteriori calcoli:
L'Orario O esprime il valore della durata d'intervento fertirriguo.Tuttavia la soluzione nutritiva raggiunge i gocciolatori in tempi diversi.Occorrerebbe quindi tenere conto di ulteriori calcoli:l=lunghezza della condotta principale=100m
Ø=diametro della condotta principale=80mm (raggio r=40mm=0,04m)
Qcp=Portata della condotta principale=6000L/ora=6m3/ora
N=numero di tubazioni della condotta principale=1
A=Area della sezione della condotta principale=πr2=3,14*(0,04)2=0,005m2
K=(l*A)/Qcp=(100*0,005)/6=0,083ore
T=K(lnN+0,6)=0,083(ln1+0,6)=0,05ore=3minuti
l=lunghezza della linea portante=60m
Ø=diametro della linea portante=60mm (r=30mm=0,03m)
Q=Portata della linea portante=350L/ora=0,35m3/ora
N=numero delle linee gocciolanti=l/D=60/1,5=40
D=Distanza tra le linee dei gocciolatori=1,5m
A=Area della sezione della linea portante=πr2=3,14*(0,03)2=0,0028m2
K=(D*A)/Qg=(1,5*0,0028)/ 0,35=0,012 ore
T=K(lnN+0,6)= 0,012(ln40+0,6)=0,05ore=3minuti
l=lunghezza delle linee gocciolanti=80m
Ø=diametro delle linee gocciolanti=25mm (r=12,5mm=0,0125m)
Qg=Portata delle linee gocciolanti=1,2L/ora=0,0012m3/ora
N=numero dei gocciolatori=l/d=80/0,4=200 gocciolatori
A=Area della sezione della linea gocciolante=πr2=3,14*(0,0125)2=0,000491m2
K=(d*A)/Qg=(0,4*0,000491)/ 0,0012=0,16ore
T=K(lnN+0,6)= 0,16(ln200+0,6)=0,94ore=56minuti
Tempo occorrente per raggiungere il gocciolatore più distante=3+3+56=62 min
In aggiunta a quanto descritto,l'intervento fertirriguo è suddivisibile in tre stadi:1)tempo t necessario per far entrare in pressione il gocciolatore più distante 2)tempo di iniezione ti della soluzione nutritiva e 3)tempo di lavaggio 3t necessario per pulire le tubazioni. Riassumendo l'intervento fertirriguo prevede una immissione di sola acqua per un tempo t, l'immissione della soluzione nutritiva e una ulteriore immissione di sola acqua a fine intervento generalmente pari a 2-3 volte il tempo per mandare l'impianto in pressione.
Tutte queste tempistiche andrebbero considerate nel calcolo sia del bilancio idrico sia nel piano fertirriguo.
La tecnica della fertirrigazione può essere eseguita con due diverse modalità:
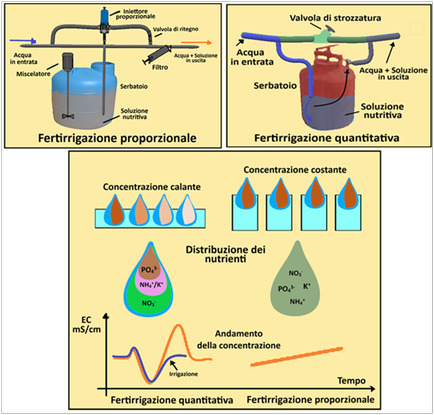 1)Fertirrigazione in continuo o quantitativa – l’apporto dei fertilizzanti viene fornito durante l’intera durata dell’irrigazione. Di conseguenza i fertilizzanti vengono erogati continuamente durante tutti gli apporti irrigui. E’un metodo pratico e relativamente più economico,ma può creare variazioni della salinità a
1)Fertirrigazione in continuo o quantitativa – l’apporto dei fertilizzanti viene fornito durante l’intera durata dell’irrigazione. Di conseguenza i fertilizzanti vengono erogati continuamente durante tutti gli apporti irrigui. E’un metodo pratico e relativamente più economico,ma può creare variazioni della salinità acontatto con le radici. Inoltre la concentrazione della soluzione
nutritiva non è costante e non è regolabile.Tutto il fertilizzante viene disciolto in un serbatoio da 50-200L e viene completamente distribuito dopo il passaggio di un quantitativo d’acqua pari a 10 volte il volume del serbatoio.
2) Fertirrigazione proporzionale – dopo aver redatto un corretto piano di concimazione e un bilancio idrico,basati in particolare sull’analisi del suolo e dell’acqua irrigua,i fertilizzanti vengono apportati in modo proporzionale al volume idrico a seconda del fabbisogno durante le varie fasi fenologiche della coltura.Vengono considerati anche i parametri climatici. Grazie a iniettori proporzionali,la concentrazione della soluzione nutritiva è costante ed è regolabile. Rappresenta la tecnica fertirrigua di maggior precisione.
Modalità operative
 Disciogliere poco per volta i fertilizzanti cominciando da quelli meno solubili e continuando con quelli gradualmente più solubili nel serbatoio riempito per ¾ di acqua e portare poi a volume tenendo la soluzione in agitazione per mezz’ora. Eventuali fertilizzanti liquidi si immettono per ultimi. In mancanza di un agitatore,si scioglie una porzione di fertilizzante (5Kg) in un recipiente (con 20L d’acqua) e si versa poi nel serbatoio preferibilmente utilizzando un cestello a setaccio con funzione di trattenere residui non disciolti.
Disciogliere poco per volta i fertilizzanti cominciando da quelli meno solubili e continuando con quelli gradualmente più solubili nel serbatoio riempito per ¾ di acqua e portare poi a volume tenendo la soluzione in agitazione per mezz’ora. Eventuali fertilizzanti liquidi si immettono per ultimi. In mancanza di un agitatore,si scioglie una porzione di fertilizzante (5Kg) in un recipiente (con 20L d’acqua) e si versa poi nel serbatoio preferibilmente utilizzando un cestello a setaccio con funzione di trattenere residui non disciolti.Evitare di utilizzare acqua fredda e prima di introdurre i fertilizzanti aspettare alcune ore per portare l’acqua a temperatura ambiente.
Solubilizzazione
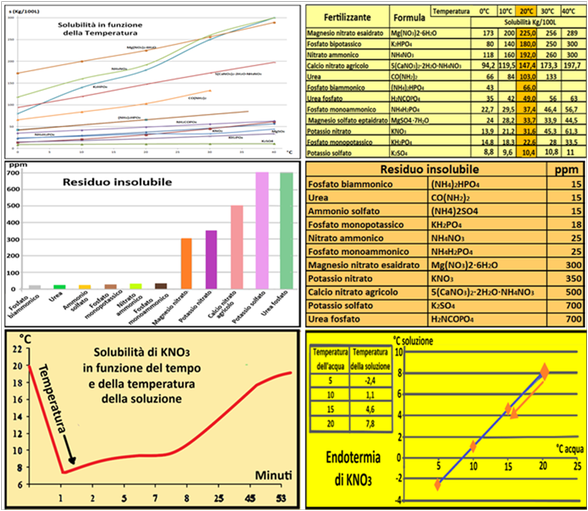
Quando si disciolgono i fertilizzanti per preparare la Soluzione madre occorre considerare alcuni importanti fattori:
- compatibilità tra fertilizzanti:miscelare fertilizzanti tra di loro non compatibili porta alla formazione di precipitati solidi insolubili.E' per tale motivo che è preferibile utilizzare tre serbatoi diversi con diversi fertilizzanti compatibili fra loro.
-quantità dei fertilizzanti: sciogliere poco per volta non più di 10-20Kg di concime ogni 100L d'acqua tenendo presenti i valori di massima solubilità specifici per ogni fertilizzante. Per es. la solubilità del Solfato di potassio è pari a 10,4 Kg/100L. Se si disciolgono 15Kg in 100L di acqua una parte del concime non si scioglierà.
-purezza dei fertilizzanti:i fertilizzanti per fertirrigazione hanno in genere un contenuto di sostanze insolubili molto basso,ma comunque presente.
-temperatura dell'acqua: l'acqua utilizzata per disciogliere i fertilizzanti deve avere una temperatura superiore ai 10°C altrimenti i fertilizzanti si sciolgono troppo lentamente.
-effetto endotermico:il Nitrato di potassio si comporta in modo particolare quando disciolto in acqua perchè ne abbassa la temperatura (reazione endotermica).Questo influisce sul tempo di solubilizzazione che diviene più lento.
-tempo di solubilizzazione:dipende
dal tipo di concime, dalla sua concentrazione e dalla temperatura dell'acqua.
-utilizzo degli acidi:a volte,per incrementare la solubilità dei fertilizzanti, alla soluzione madre si aggiungono direttamente 0,5litri/m3 di un acido, generalmente acido fosforico all'85%,il quale è relativamente meno pericoloso rispetto ad altri acidi.Tuttavia occorre prestare attenzione a non eccedere nel quantitativo di fosforo apportato e soprattutto occorre considerare che l'acido fosforico non è compatibile con fertilizzanti contenenti Calcio o Magnesio. In tal caso si può utilizzare l'Acido nitrico.
Gli acidi,anche diversi da quello fosforico,possono essere utilizzati anche quando si formano eventualmente soluzioni lattiginose nel disciogliere i fertilizzanti.In questo caso il fertilizzante si scioglie poco per volta il fertilizzante in un contenitore con una certa quantità di acqua,si aggiunge poco per volta l'acido,si mescola,si aggiunge se necessario altra acqua e si versa nel serbatoio.
Miscibilità dei fertilizzanti
 Quando si mescolano tra di loro più concimi chimici,in particolare quelli per fertirrigazione e per via fogliare, occorre verificare, leggendo le etichette, se sono tra loro compatibili e quindi miscelabili e in quali dosi.
Quando si mescolano tra di loro più concimi chimici,in particolare quelli per fertirrigazione e per via fogliare, occorre verificare, leggendo le etichette, se sono tra loro compatibili e quindi miscelabili e in quali dosi.Per comprendere il motivo per cui alcuni concimi sono o non sono compatibili occorre,come sempre, conoscere un po’ di chimica.
Generalmente due o più concimi(o concimi con fitosanitari)non sono miscibili tra loro quando,disciolti in acqua,danno origine a ioni di carica opposta che attraendosi formano nuovi composti che non sono solubili in acqua,ossia precipitano.
Tali sostanze precipitate ostruiscono l'impianto di fertirrigazione o le pompe irroratrici utilizzate nella irrigazione fogliare.
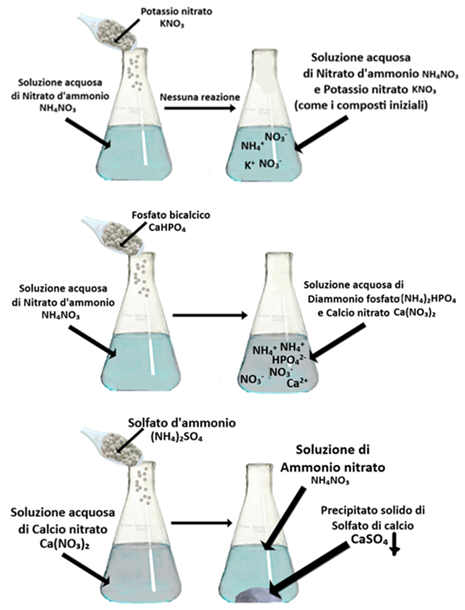 Si considerino i seguenti esempi:
Si considerino i seguenti esempi:Miscibilità del Nitrato ammonico con Potassio nitrato
NH₄NO₃ + KNO₃ → Nessuna reazione. I due composi danno origine ai cationi NH4+ e K+ ,mentre l'anione è lo stesso,ossia NO3-.Di conseguguenza lo scambio di ioni produce nuovamente i due composti iniziali. I due concimi sono perfettamente miscelabili.
Miscibilità del Nitrato ammonico con Calcio fosfato acido
2NH₄NO₃ + CaHPO₄ → (NH₄)₂HPO₄ + Ca(NO₃)₂
Il primo composto origina gli ioni NH4+ e NO3-,mentre il secondo gli ioni Ca2+ e HPO4-.Lo scambio di ioni produce Calcio nitrato e Diammonio fosfato che sono composti solubili.i Con un po’ di attenzione i due concimi si possono miscelare.
Miscibilità del Calcio nitrato con Ammonio solfato
Ca(NO₃)₂ + (NH₄)₂SO₄ → 2NH₄NO₃ + CaSO₄↓
Il primo composto origina gli ioni Ca2+ e NO3-,mentre il secondo gli ioni NH4+ e SO42-.
La reazione produce due composti di cui uno (il solfato di
calcio CaSO4) non è idrosolubile e precipita (↓). Con un po’ di attenzione i due concimi si possono miscelare, ma non si possono utilizzare per l’irrigazione fogliare o in fertirrigazione.
Controllo del pH e dell'EC
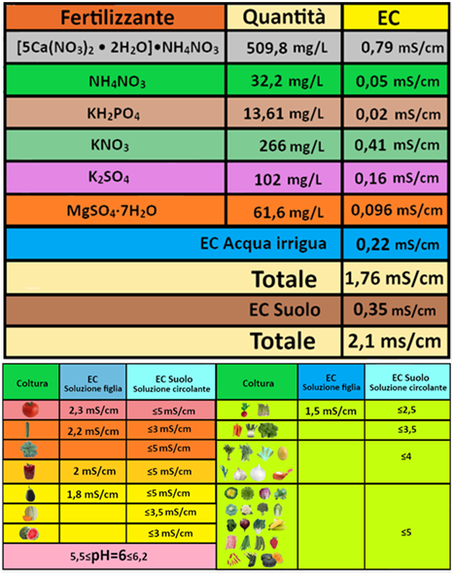 Una volta calcolati i quantitativi di concime da utilizzare,occorre valutare se l'acqua irrigua contenente la soluzione nutritiva (Soluzione figlia)presenza pH ed EC adeguati.Mentre il valore del pH,misurato con un pHmetro, deve essere sempre pari a 5,5-6,2,con un valore ottimale di 6,il valore di Ec dipende dalla coltura e per il Peperone deve essere EC≤2mS/cm.
Una volta calcolati i quantitativi di concime da utilizzare,occorre valutare se l'acqua irrigua contenente la soluzione nutritiva (Soluzione figlia)presenza pH ed EC adeguati.Mentre il valore del pH,misurato con un pHmetro, deve essere sempre pari a 5,5-6,2,con un valore ottimale di 6,il valore di Ec dipende dalla coltura e per il Peperone deve essere EC≤2mS/cm.Il valore di Ec della soluzione figlia si può calcolare con la formula:EC=0,00156*mg/L di concime
Per es, l'utilizzo di 509,8mg/L di Calce agricola comporta un aumento di EC pari a: EC=0,00156*509,8=0,79 mS/cm
Analogamente si svolge lo stesso calcolo per tutti gli altri fertilizzanti ad eccezione dell'acido utilizzato per neutralizzare i bicarbonati e dei microelementi poichè il loro contributo su EC è
trascurabile.
Il valore totale di EC risulta pari a 1,76mS/cm per la soluzione figlia e 2,1mS/cm per la soluzione circolante a livello radicale,valori del tutto adeguati per la coltura.I valori si verificano poi concretamente con un conduttivimetro prelevando un campione di soluzione figlia nutritiva a valle dell'impianto.
Talvolta,a causa di diverse variabili non sempre prevedibili, può accadere che il valore dell'EC e di pH si discostino da quelli considerati ottimali.
Si ammetta per esempio che il valore di EC sia pari a 3mS/cm,valore troppo elevato per il Peperone.Per correggere l'EC elevata si può:
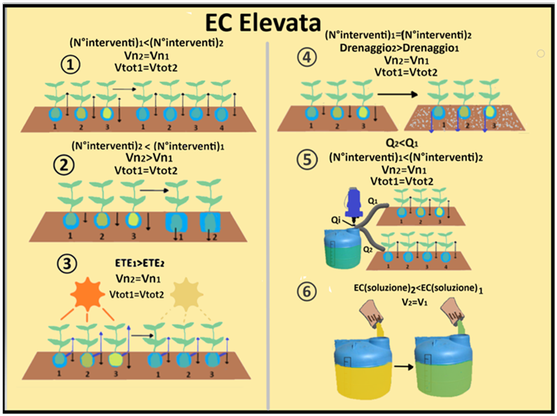 1)aumentare il numero degli interventi fertirrigui senza variare la concentrazione della soluzione nutritiva e il volume irriguo.Per es.invece di fertirrigare tre volte al giorno per 1 ora 14 minuti ad ogni intervento,si può irrigare quattro volte al giorno per 18,5 minuti.In questo modo si fornisce più tempo alle colture e al terreno di assorbire i nutrienti evitandone l'accumulo.
1)aumentare il numero degli interventi fertirrigui senza variare la concentrazione della soluzione nutritiva e il volume irriguo.Per es.invece di fertirrigare tre volte al giorno per 1 ora 14 minuti ad ogni intervento,si può irrigare quattro volte al giorno per 18,5 minuti.In questo modo si fornisce più tempo alle colture e al terreno di assorbire i nutrienti evitandone l'accumulo.2)diminuire il numero degli interventi fertirrigui aumentando il volume irriguo.In questo modo si diluisce la soluzione nutritiva evitandone l'accumulo.
3)eseguire gli interventi alla sera o al mattino presto quando l'evapotraspirazione è minore. In questo modo la soluzione nutritiva non si concentra grazie alla minore evaporazione dell'acqua.
4)aumentare il drenaggio del suolo in modo tale che parte della soluzione nutritiva venga lisciviata.
5)regolare (rallentare) la portata dell'iniettore in modo tale da diminuire la concentrazione della soluzione nutritiva.In questo caso bisogna anche aumentare il numero degli interventi fertirrigui.
6)preparare in ultima analisi una nuova soluzione madre ricalcolando nuovi quantitativi di fertilizzanti e preferendo i solfati e gli acidi.
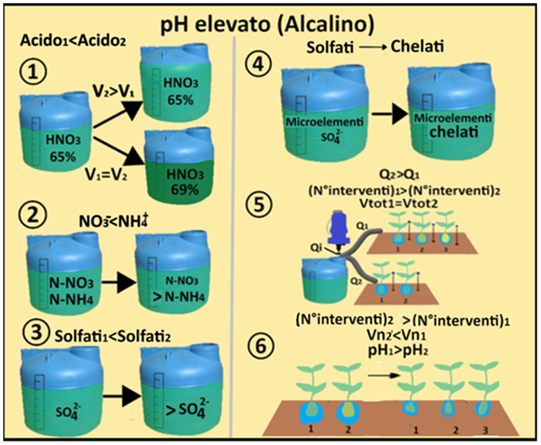 Per correggere un pH alcalino si può:
Per correggere un pH alcalino si può:1)utilizzare un quantitativo maggiore di acido o con un titolo maggiore,prestando però attenzione all'incremento di sostanza nutritiva in esso contenuta (azoto,fosforo o zolfo).
2)preferire fertilizzanti che apportino più Azoto ammoniacale rispetto a quello nitrico.Questo perchè lo ione ammonio ha carattere acido.
3)aumentare la concentrazione dei solfati prestando però attenzione all'incremento di sostanze nutritive in essi contenute e all'aumento di EC.
4)preferire fertilizzanti che apportino microelementi in forma chelata.
5)regolare (aumentare) la portata dell'iniettore per gli acidi in modo tale da incrementarne la concentrazione nella soluzione nutritiva.In questo caso bisogna anche diminuire il numero degli interventi fertirrigui.
6)aumentare il numero degli interventi fertirrigui diminuendone il volume irriguo.In questo modo si concentra la soluzione nutritiva abbassandone il pH a valori più acidi.
Ovviamente quando si deve correggere una EC troppo bassa o un pH tropo acido si adottano i rimedi precedenti ma in senso contrario.
In tutti i casi,sia per correggere Ec sia per correggere il pH occorre evitare di alterare l'apporto irriguo totale e i fabbisogni nutritivi richiesti dalla coltura.Inoltre occorre adottare soluzioni che siano fra loro compatibili quando bisogna correggere sia l'EC sia il pH.
Impianto di Fertirrigazione
Consiste schematicamente di un sistema di pompaggio dell'acqua irrigua,riduttori della pressione d'esercizio, contalitri,filtri,serbatoi per le soluzioni nutritive e sistemi di iniezione delle soluzioni. Tramite questo impianto le soluzioni nutritive vengono poi erogate tramite irrigazione a goccia.
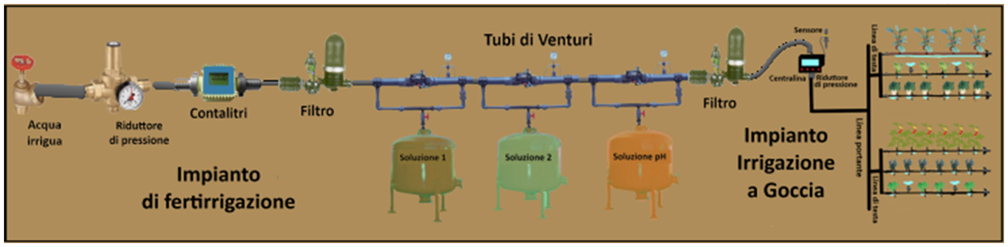
 Pompe - servono per il pescaggio dell'acqua irrigua e possono essere sommerse,come nel caso di cisterne sotterranee oppure centrifughe da collocare all'esterno della cisterna d'acqua. Ovviamente non servono se l'acqua proviene da un rubinetto per l'acqua potabile.
Pompe - servono per il pescaggio dell'acqua irrigua e possono essere sommerse,come nel caso di cisterne sotterranee oppure centrifughe da collocare all'esterno della cisterna d'acqua. Ovviamente non servono se l'acqua proviene da un rubinetto per l'acqua potabile.Riduttore di pressione - serve per diminuire la pressione dell'acqua in entrata.
Contalitri - necessario per stabilire la quantità di acqua in entrata.
Filtri - servono per trattenere le impurità nell'acqua e possono essere di diverso tipo.
1)Idrocicloni:è un pre-filtro per acque con elevato contenuto di sabbia. E' costituito da un corpo centrale che ruotando provoca la collisione della sabbia sulla parete del corpo e successiva caduta sul fondo del filtro, lasciando uscire solo l'acqua dalla parte superiore.
2)Filtri a graniglia: costituiti da un contenitore che blocca le impurità attraverso la filtrazione operata da sabbia o ghiaietto poste all'interno.Vengono montati prima del fertirrigatore, per evitare che gli elementi fertilizzanti utilizzati possano favorire lo sviluppo di microrganismi all’interno del filtro stesso e devono essere sempre abbinati a filtri a dischi o a rete montati più a valle.Richiedono pulizia tramite un'inversione del flusso d'acqua.
3)Filtri a rete: molto utilizzati,sono costituiti da una rete con maglie di diversa dimensione in grado di bloccare solo impurità di grandi dimensioni.Sono abbinati ad un idrociclone o ad un filtro a sabbia. La pulizia viene eseguita manualmente.
4)Filtri a dischi:sono costituiti da una serie di lamelle circolari inserite una sopra l'altra e con superficie
scabrosa.La pulizia viene eseguita manualmernte o automatizzata con una centralina. Quando il filtro è intasato,un manometro rileva la differenza di pressione dell'acqua prima e dopo il passaggio dal filtro e si attiva la pulizia tramite inversione di flusso.Se ne collocano una a monte e una a valle dell'impianto.
 Iniettori - fondamentali per il pescaggio delle soluzioni nutritive e in numero pari a quello dei serbatoi. Vengono classificati in base alla modalità di iniezione:
Iniettori - fondamentali per il pescaggio delle soluzioni nutritive e in numero pari a quello dei serbatoi. Vengono classificati in base alla modalità di iniezione:1)Tubi di Venturi:consiste in un tubo con una strozzatura centrale in grado di provocare una depressione in linea tra il tratto precedente e quello successivo al punto di installazione del dispositivo.Ciò consente di aspirare la soluzione concentrata da un recipiente aperto realizzandone la diluizione in relazione al differenziale di pressione. Maggiore è la differenza di pressione, maggiore è l’aspirazione della soluzione stock.I Tubi di Venturi vengono commercializzati con

diversi materiali e diametri in modo da garantire le esigenze d’iniezione dei fertilizzanti e degli acidi. Sono economici,non richiedono energia elettrica per il funzionamento e non richiedono manutenzione.Pur essendo molto utilizzati richiedono valvole,manometri e flussimetri installati sulla condotta principale,poichè non sono particolarmente precisi a causa del rapporto di diluizione che non è costante, ma varia a seconda della portata e della differenza di pressione della condotta. A causa di ciò si possono avere variazioni istantanee del pH o dell'E.C. della soluzione nutritiva. Ogni tubo Venturi è accompagnato da una tabella in cui si specifica la portata dell’iniettore per determinati valori della pressione in ingresso e della differenza di pressione.
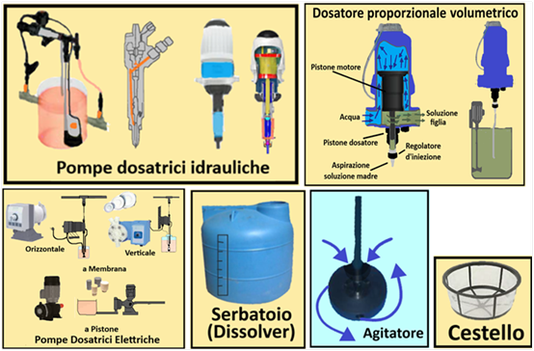
2)Pompe meccaniche a dosaggio volumetrico: costituite da una pompa a stantuffo che grazie alla pressione dell'acqua di passaggio aziona un secondo pistoncino in un cilindro più
piccolo, che aspira un determinato volume di soluzione madre, proporzionale al volume d'acqua passato
attraverso la pompa. La loro portata varia da 0,5 a 40 m3/h. Non richiedono energia elettrica, sono precisi e permettono di variare il rapporto di dosaggio con una ghiera graduata.Alcune parti si consumano però facilmente e si possono avere perdite di carico nell'impianto,causate dall'uso di parte dell'energia dell'acqua per l'aspirazione.
Il Dosatore proporzionale volumetrico è,subito dopo il Tubo di Venturi,l'iniettore più utilizzato.
3)Pompe elettriche a dosaggio volumetrico: per funzionare utilizzano energia elettrica, i cui impulsi sono regolati da un contalitri che invia un segnale proporzionale al flusso idrico, dal quale dipende la velocità di pompaggio. Le pompe elettriche possono essere pompe a membrana o pompe a pistone.Non presentanoperdite di carico, sono relativamente economiche ma non sono molto precise nel controllo dell'E.C. e del pH.
Serbatoi per le soluzioni (Dissolver)- se ne utilizzano 3 e devono essere di materiale plastico in modo che non si corrodano.
Contengono le soluzioni nutritive e gli acidi per la regolazione del pH. In genere si utilizzano con una capacità di 1000L ma possono anche essere da 300 e 500L. Spesso sono integrati con un agitatore elettrico per mescolare la soluzione.
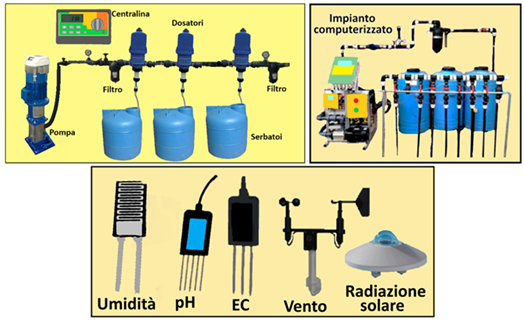
Fertirrigatori computerizzati - sono in grado di distribuire soluzioni nutritive diverse e sono dotati di flussimetri elettronici ed elettrovalvole di precisione per il controllo del flusso della soluzione madre da iniettare.Molto costosi.
Sensori- nei sistemi fertirrigui più precisi,ad integrazione vengono installati dei sensori per la misurazione del pH,dell'elettroconducibilità, dell'umidità del suolo,della direzione e velocità del vento, dell'irraggiamento solare(piranometri), ecc.Se professionali sono piuttosto costosi.I sensori del pH e dell'EC devono essere collocati lontani dal punto di iniezione e,poichè le sonde sono più precisione in condizioni di bassa pressione idrica, è preferibile collocarle su un by-pass collegato alla linea principale.
Operazioni di Manutenzione
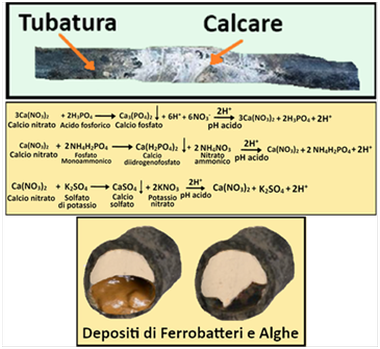 Calcare e Precipitati insolubili - L'inconveniente principale tipico degli impianti di fertirrigazione è la formazione di calcare che ostruisce le condutture e gli apparecchi.L'utilizzo di acidi permette la neutralizzazione del calcare e la ripulitura dell'impianto.Oltre al calcare,gli acididisciolgono
Calcare e Precipitati insolubili - L'inconveniente principale tipico degli impianti di fertirrigazione è la formazione di calcare che ostruisce le condutture e gli apparecchi.L'utilizzo di acidi permette la neutralizzazione del calcare e la ripulitura dell'impianto.Oltre al calcare,gli acididisciolgonoeventuali precipitati che si formano per es. tra fosfati e calcio e solfati e calcio.Ovviamente tra gli acidi da utilizzare quello fosforico è da escludere poichè formano gli stessi precipitati. Per la ripulitura delle tubazioni si può anche utilizzare l'Acido cloridrico che è poco costoso,ma che non deve essere utilizzato con colture in atto poichè contiene cloro fitotossico.
Microrganismi - quando l'acqua irrigua contiene anche solo 0,5mg/L di ferro,si può innescare lo sviluppo di ferro-batteri che provocano la formazione di una melma e incrostazioni ferrose che occludono le tubazioni. L'utilizzo di Ipoclorito di sodio provoca la disinfezione e morte dei batteri alterandone processi enzimatici vitali dopo aver attraversato facilmente la loro parete cellulare.L' Ipoclorito di sodio (Candeggina) si introduce a monte dell'impianto fertirriguo (anche nella soluzione nutritiva) e con una quantità pari a: Q=Cl*P/Clpc*10
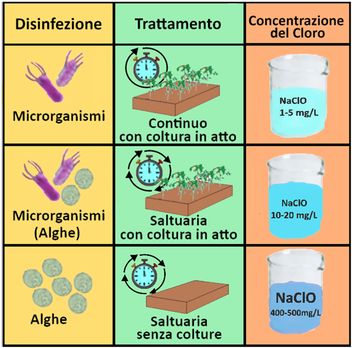 dove Q=quantità di ipoclorito da iniettare nell'impianto;
dove Q=quantità di ipoclorito da iniettare nell'impianto;Cl=concentrazione di cloro desiderata;
P=Portata dell’impianto di fertirrigazione (L/ora);
Clc = Concentrazione di cloro nel prodotto commerciale utilizzato.
La concentrazione di Cloro desiderata varia a seconda del periodo in cui si effettua il trattamento. Assumendo di effettuare un trattamento a fine a coltivazione con ipoclorito di sodio con concentrazione 30mg/L si ha: Q=500*1/30*10=1,67mg/L
Poichè il cloro è fitotossico è preferibile utilizzarlo a fine coltura oppure con quantità e tempistiche da valutare attentamente.
Funghi patogeni - La soluzione nutritiva,essendo distribuita attraverso un ambiente confinato come le linee gocciolanti,può diventare facile veicolo di funghi patogeni come Pythium e Phytophthora che si possono quindi diffondere velocemente a tutta la superficie irrigata e alle colture.Diverse sono le tecniche per la disinfezione,ma i più semplici e meno costosi sono rappresentati dall’utilizzo di Filtri a sabbia,dalla clorazione con Ipoclorito di sodio e dall’introduzione nell’impianto irriguo di fungicidi.
Alghe - le alghe brune si diffondono all'interno dei tubi di irrigazione mentre le alghe verdi sulla superficie dei gocciolatori.L'acidificazione dell'acqua e la clorazione permettono di eliminare almeno le prime.
