Analisi del Suolo
MENU
L'ANALISI DEL SUOLO
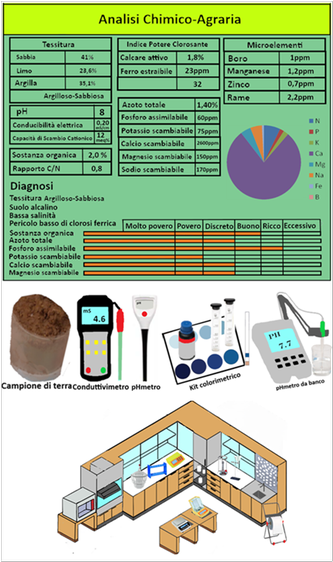 L'analisi del terreno permette di ottenere informazioni utili sulla qualità del suolo e di apportare eventualmente specifiche correzioni per migliorarlo.Lo studio del terreno trova anche importante applicazione per quanto riguarda la concimazione e l'irrigazione.
L'analisi del terreno permette di ottenere informazioni utili sulla qualità del suolo e di apportare eventualmente specifiche correzioni per migliorarlo.Lo studio del terreno trova anche importante applicazione per quanto riguarda la concimazione e l'irrigazione.Per l'analisi si possono seguire tre vie:1)utilizzo di strumenti digitali portatili o da banco o di kit con appositi reagenti che hanno il vantaggio della immediatezza e facilitàdi esecuzione ma non sono disponibili per tutte le analisi e i kit colorimetrici risentono di una valutazione del colore da parte di chi conduce l'analisi.
2)utilizzo di metodi empirici basati sulla osservazione soggettiva che non necessitano in genere di alcun particolare strumento ma non sono molto accurati;3)utilizzo di metodi chimici ufficiali che se ben condotti portano a risultati precisi e accurati.
L'analisi chimica del terreno viene in genere affidata a laboratori di analisi. Questo perchè sono richiesti materiali, attrezzature e procedure in dotazione e a conoscenza dei chimici. Tuttavia,per coloro che possono permettersi un certo esborso economico e che hanno una certa dimestichezza con la chimica,si descrivono le analisi del terreno più significative sotto riportate in ordine di esecuzione. Si precisa che tali analisi richiedono attenzione per quanto riguarda l'utilizzo di sostanze chimiche molto pericolose, anche se facilmente reperibili in commercio. Anche se sconsigliato,in particolare se si vogliono ottenere risultati accurati,alcuni strumenti possono essere sostituiti con altri rudimentali eventualmente descritti.
Vetreria e Strumenti per solidi e pesatura
 Spatole - si utilizzano per prelevare le polveri (sostituibili con cucchiaini).
Spatole - si utilizzano per prelevare le polveri (sostituibili con cucchiaini).Navicelle per pesata - sono contenitori molto leggeri usati per trasferire polveri (sostituibili con carta oleata per alimenti). A volte si usano pesafiltri.
Setacci - indispensabili per l'analisi del terreno poichè deve essere frantumato molto finemente. la grandezza delle maglie deve essere di 2mm;0,5mm;0,2mm
Mortai con pestello - utilizzati per macinare finemente le polveri.Possono essere di diverso materiale (anche ad uso casalingo).
Imbuti per polveri - utilizzato per trasferire polveri in recipienti stretti (sostituibili con qualsiasi imbuto).
Pesafiltri- d. 80mm
Vetreria e Strumenti per liquidi
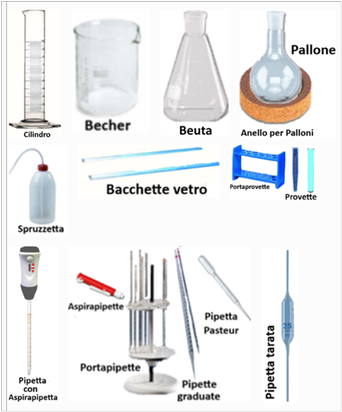 Cilindri graduati - si utilizzano per contenere liquidi. Nell'analisi del suolo occorrono cilindri da 1L (=1000ml).
Cilindri graduati - si utilizzano per contenere liquidi. Nell'analisi del suolo occorrono cilindri da 1L (=1000ml).Becker - sono i contenitori per liquidi più utilizzati e nell'analisi del suolo occorrono becker da 1L (=1000ml); 500ml;250ml;100ml e 50ml
Beute - utilizzabili al posto del becker (da 200;250;300 e 500mL)
Palloni - da 1L;500ml e 50ml,usati per le distillazioni e tenuti in piano con anelli di sughero o plastica.
Spruzzetta - è semplicemente un flacone con beccuccio che si riempie con acqua distillata.
Bacchette di vetro - usate per mescolare manualmente
Provette - da saggio (a fondo concavo) o da centrifuga a fondo conico (da 50;100 e 250ml).
Pipetta Pasteur - è semplicemente un contagocce.
Pipette graduate - sono utilizzate per prelevare ed erogare liquidi con molta precisione. Devono essere munite di un aspirapipette e possono essere graduate o tarate (le tarate da10;20 e 25ml). Per il loro alloggiamento si può acquistare un portapipette.
Esecuzione,Vetreria e Strumenti per Essiccazione e Determinazione della Massa
 Essiccazione - Tutto ciò che deve essere soggetto a pesatura come i campioni da analizzare, i reagenti solidi e persino la vetreria devono essere completamente anidri,cioè senz’acqua,altrimenti si pesa anche l'acqua contenuta,le tracce di grasso,ecc. Per pesare le sostanze,queste vanno trasferite ovviamente in un contenitore che in genere è un pesafiltri o un becker di vetro di cui occorre conoscere la massa certa. La massa del contenitore non si misura direttamente sulla bilancia ma tramite una procedura che consiste nel lavare il contenitore con acqua distillata,collocarlo in stufa termostatata a 110°C per due ore,prelevarlo con pinze metalliche e raffreddarlo in un essiccatore (recipiente di vetro robusto con coperchio a tenuta stagna in cui le sostanze rimangono al riparo dall'umidità atmosferica anche grazie a materiale igroscopico come il gel di silice posizionato alla base).Si pesa il contenitore annotando il valore.
Essiccazione - Tutto ciò che deve essere soggetto a pesatura come i campioni da analizzare, i reagenti solidi e persino la vetreria devono essere completamente anidri,cioè senz’acqua,altrimenti si pesa anche l'acqua contenuta,le tracce di grasso,ecc. Per pesare le sostanze,queste vanno trasferite ovviamente in un contenitore che in genere è un pesafiltri o un becker di vetro di cui occorre conoscere la massa certa. La massa del contenitore non si misura direttamente sulla bilancia ma tramite una procedura che consiste nel lavare il contenitore con acqua distillata,collocarlo in stufa termostatata a 110°C per due ore,prelevarlo con pinze metalliche e raffreddarlo in un essiccatore (recipiente di vetro robusto con coperchio a tenuta stagna in cui le sostanze rimangono al riparo dall'umidità atmosferica anche grazie a materiale igroscopico come il gel di silice posizionato alla base).Si pesa il contenitore annotando il valore.Si ripete l’operazione (escluso il lavaggio) e con riscaldamento di 1ora. Se il peso del contenitore è costante la procedura è terminata altrimenti si ripete ancora per tempi più brevi fino a quando il peso diventa costante e si annota il valore. Il procedimento risulta alquanto noioso poichè ripetitivo e con lunghi tempi di attesa.Ciononostante la massa del contenitore ottenuta è valida all'infinito per analisi successive (e per questo occorre annotarne e conservarne il valore).Per pesare piccoli quantitativi di sostanze, queste si possono posare su una cartina oleata o in una navicella di peso trascurabile.
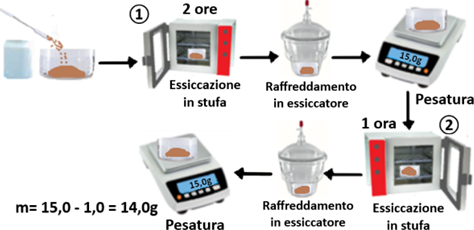
Per pesare quantitativi non trascurabili di sostanze o campioni di terra,dopo aver pesato il recipiente come descritto in precedenza,si trasferisce il campione nel recipente e si ripete il procedimento descritto finchè la massa del recipiente e del campione diventano costanti.La massa del campione si ottiene sottraendo il peso noto del recipiente (tara) da quello del recipiente con il campione.
Mentre per i contenitori la misura della massa si esegue una sola volta,per alcuni reagenti solidi che tendono ad assorbire l'acqua dell'umidità atmosferica, occorre ripetere il procedimento ad ogni analisi.
Un metodo che consente di accelerare i tempi è fornito dall'utilizzo di un forno a microonde al posto della stufa.


Determinazione della massa - Per pesare le sostanze occorre necessariamente una bilancia. Per pesare quantitativi in grammi g e decigrammi (una cifra dopo la virgola) si può utilizzare una Bilancia tecnica o una buona bilancia da cucina. Per pesare quantitativi nell'ordine dei milligrammi mg (3 cifre dopo la virgola) è necessaria una Bilancia analitica,molto accurata ma costosa e delicata (ha una protezione in vetro per evitare che l'aria alteri la determinazione della massa e viene posata su un tavolo molto robusto per evitare vibrazioni).
Esecuzione e Strumenti per Riscaldamento
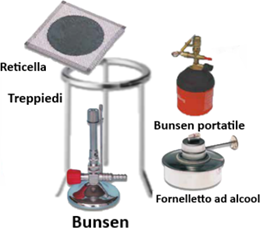
Il riscaldamento non si esegue quasi mai a contatto diretto con una fiamma a causa della pericolosità dei reagenti chimici. Le tecniche di riscaldamento possono essere eseguite:
- ponendo il contenitore con la sostanza da scaldare su una reticella metallica con disco di ceramica sostenuta da un treppiedi e accendendo uno speciale fornello a gas detto ''Becco Bunsen'' di differente tipologia a seconda che sia alimentato da metano (il gas da cucina) o gpl (in bombole). In alterantiva esistono Bunsen portatili con bomboletta sostituibile.
- con Fornelletto ad alcool per riscaldamenti blando
- tramite Bagnomaria,ossia ponendo il becker con la soluzione in esame in un altro becker più grande contenente acqua (anche di rubinetto) che si porta ad ebollizione tramite un fornello. Tra la fiamma e il bagnomaria si interpone un treppiedi con reticella. E' una tecnica molto utilizzata ma non consente di
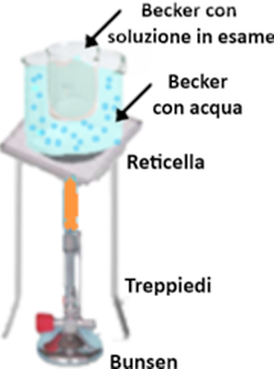
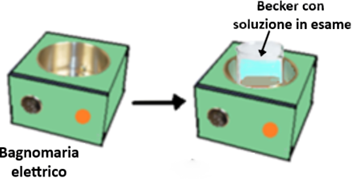
mantenere la temperatura costante ad un certo valore.Il problema si risolve utilizzando un Bagnomaria elettrico tramite una Piastra riscaldante,che oltre a permettere l'impostazione della temperatura,può avere anche funzione di agitatore in modo che la soluzione oltre che riscaldata sia anche mentenuta in agitazione.
I contenitori caldi si afferrano con apposite pinze metalliche e devono essere di vetro,


più precisamente in pyrex che sopporta alte temperature.
Quando si riscalda una soluzione liquida si dice ''portare a bollore'' quando appunto la soluzione si porta a ebollizione per un determinato tempo; si dice ''portare a secchezza'' quando una soluzione si scalda a lungo facendo evaporare il solvente e lasciando un residuo solido.
 Calcinazione – tecnica di riscaldamento ad alta temperatura che consente di eliminare le sostanze volatili da un composto e/o per facilitare la fusione di composti che resistono al calore.Si esegue utilizzando un piccolo contenitore detto crogiolo appoggiato su un apposito sostegno triangolare per crogioli a sua volta collocato su un treppiede. I crogioli sono in genere di porcellana e sono muniti di un coperchio che,non essendo a tenuta stagna,permette ai vapori di diffondersi all’esterno. Le alte temperature si raggiungono tramite un bunsen. Molto spesso la sostanza in esame viene contenuta in una carta da filtro che deve bruciare senza lasciare residui (carta da filtro a basso contenuto in ceneri).
Calcinazione – tecnica di riscaldamento ad alta temperatura che consente di eliminare le sostanze volatili da un composto e/o per facilitare la fusione di composti che resistono al calore.Si esegue utilizzando un piccolo contenitore detto crogiolo appoggiato su un apposito sostegno triangolare per crogioli a sua volta collocato su un treppiede. I crogioli sono in genere di porcellana e sono muniti di un coperchio che,non essendo a tenuta stagna,permette ai vapori di diffondersi all’esterno. Le alte temperature si raggiungono tramite un bunsen. Molto spesso la sostanza in esame viene contenuta in una carta da filtro che deve bruciare senza lasciare residui (carta da filtro a basso contenuto in ceneri).Esecuzione,Vetreria e Strumenti per Filtrazione,Centrifugazione,Miscelazione
 Filtrazione - Ha lo scopo di separare la fase liquida da quella solida di una soluzione. Si utilizza un imbuto eventualmente sorretto da un sostegno ad anello nel quale viene inserito un cono di carta da filtro così preparata:un disco di carta da filtro viene piegata a metà in orizzontale e verticale e la si inserisce nell'imbuto in modo che assumi la forma conica.Si bagna poi con un pò di acqua distillata per farla aderire all'imbuto. Si versa lentamente la soluzione da filtrare nell'imbuto in modo che in esso rimanga un residuo solido e in un becker di raccolta rimanga la fase liquida detta filtrato. Per ''lavaggio'' si intende la bagnatura con acqua distillata del residuo eseguita più volte.
Filtrazione - Ha lo scopo di separare la fase liquida da quella solida di una soluzione. Si utilizza un imbuto eventualmente sorretto da un sostegno ad anello nel quale viene inserito un cono di carta da filtro così preparata:un disco di carta da filtro viene piegata a metà in orizzontale e verticale e la si inserisce nell'imbuto in modo che assumi la forma conica.Si bagna poi con un pò di acqua distillata per farla aderire all'imbuto. Si versa lentamente la soluzione da filtrare nell'imbuto in modo che in esso rimanga un residuo solido e in un becker di raccolta rimanga la fase liquida detta filtrato. Per ''lavaggio'' si intende la bagnatura con acqua distillata del residuo eseguita più volte.Centrifugazione - l'operazione di centrifugazione consente di separare la fase solida da quella liquida di una sospensione. Il materiale da centrifugare si introduce in apposite provette da centrifuga a fondo conico. Nella centrifuga,oltre alla provetta in esame si colloca anche una provetta nell'estremità opposta con un quantitativo d'acqua in modo che l'apparecchio sia bilanciato e le provette non si rompano durante la centrifugazione. Dopo la centrifugazione a determinati giri al minuto nella provetta si deposita sul fondo la fase solida mentre quella lipida rimane in superficie e si chiama surnatante (in commercio esistono anche centrifughe manuali oppure si può adattare una comune centrifuga da insalata).Il surnatante si preleva in genere con una pipetta Pasteur.
Miscelazione - Per mescolare soluzioni liquide si può semplicemente utilizzare una bacchetta di vetro. Tuttavia abbastanza frequentemente la soluzione va tenuta in agitazione per tempi più o meno lunghi. In questo caso si utilizzano Agitatori magnetici spesso provvisti anche di regolazione della temperatura e di una ancoretta magnetica che ruota all'interno della soluzione facilitando la miscelazione.Se la soluzione è molto densa si utilizzano invece Agitatori meccanici ad asta.
Esecuzione,Vetreria e Strumenti per Preparazione di soluzioni e Titolazioni


Preparazione di soluzioni a concentrazione nota - Una soluzione ad una determinata concentrazione si ottiene sciogliendo una opportuna quantità di sostanza solida o liquida in un Matraccio,cioè un contenitore tarato e munito di tappo a smeriglio di una determinata capacità.Dopo la dissoluzione o il miscelamento si ''porta a volume'' con altra acqua distillata,cioè fino alla tacca segnata sul collo del matraccio. Si capovolge poi per 3-4 volte in senso opposto il matraccio con il suo tappo in modo che la soluzione sia ben omogenea. A rigore la sostanza solida dovrebbe essere sottoposta ad essiccazione e pesatura come descritto in precedenza.
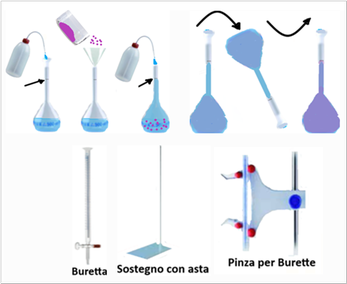 Nell'analisi del suolo occorrono matracci da 1L (=1000ml);500; 250; 200;125;100;50;25;20;15;10 e 0,5ml.Non sempre le soluzioni preparate rimangono stabili per lungo tempo ed è quindi consigliabile consumarle al momento dell'uso.Alcune soluzioni da utilizzare in quantità modesta si possono conservare in bottigliette di vetro scuro delle bottiglie di Ranvier. Le soluzioni di basi forti vanno invece conservate in bottigliette di plastica.
Nell'analisi del suolo occorrono matracci da 1L (=1000ml);500; 250; 200;125;100;50;25;20;15;10 e 0,5ml.Non sempre le soluzioni preparate rimangono stabili per lungo tempo ed è quindi consigliabile consumarle al momento dell'uso.Alcune soluzioni da utilizzare in quantità modesta si possono conservare in bottigliette di vetro scuro delle bottiglie di Ranvier. Le soluzioni di basi forti vanno invece conservate in bottigliette di plastica.Titolazione - E' una tecnica che consente di calcolare la concentrazione di una soluzione e la quantità di sostanza in essa contenuta.Dopo aver preparato una soluzione a una determinata concentrazione denominata titolante,la si versa,tramite un imbuto,in contenitore cilindrico munito di rubinetto detto Buretta tenendo il rubinetto chiuso. Nella buretta in genere si versa un volume di titolante corrispondente alla capacità della buretta stessa.Le burette vengono sorrette da sostegni con asta munite di una appropriata pinza. Al di sotto si pone un becker con la soluzione del
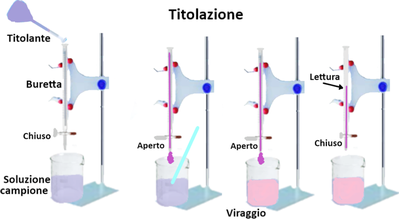
campione da analizzare eventualmente con l'aggiunta di alcune gocce di colorante detto indicatore. Si apre il rubinetto e si lascia scolare la soluzione nella buretta molto lentamente fino a quando la soluzione nel becker tenuta in agitazione cambia colore (punto di viraggio).Si chiude il rubinetto e si legge il volume di soluzione titolante che è stata utilizzata. Tramite opportuni calcoli si ricava la quantità di un determinato composto nella soluzione del campione nel becker. In genere la soluzione di titolante si prepara al momento dell'uso e anche la sua concentrazione esatta dovrebbe essere confermata tramite titolazione. Si definisce titolazione in ''bianco'' una titolazione effettuata con tutti i procedimenti e reagenti dell'analisi tranne il
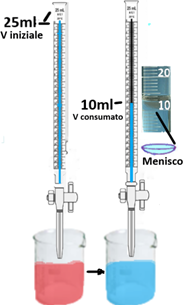
campione in esame.Se per es. si deve titolare con un determinato titolante una soluzione opportunamente preparata contenente una quantità da determinare di una certa sostanza,nella titolazione in bianco si prepara lo stesso titolante e la stessa soluzione da titolare senza però che in essa sia presente la sostanza da determinare.
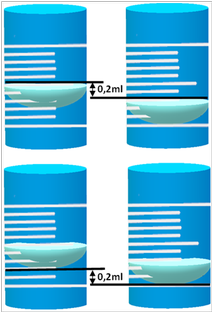
Lettura del volume - Nella vetreria a collo lungo e stretto come le burette il liquido all'interno non si mantiene orizzontale ma forma un cosiddetto menisco concavo che rende confusa la lettura precisa del volume. In genere il volume corrisponde a quello letto alla base del menisco. Nelle titolazioni il problema in realtà è inesistente poichè ciò che conta è assumere lo stesso riferimento che può essere la base o la superficie del menisco indifferentemente sia per la lettura del volume iniziale sia per quello finale consumato.
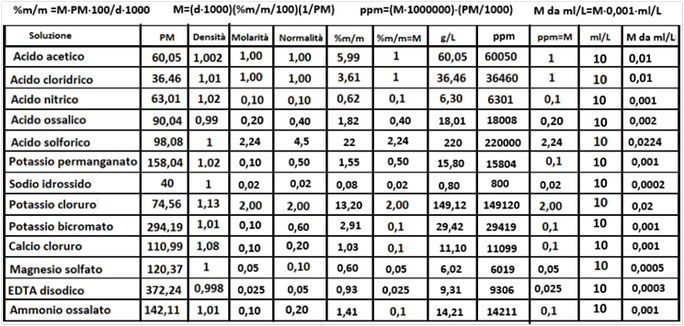
Concentrazione delle soluzioni - La concentrazione di una soluzione si può esprimere in molti modi e, senza entrare in dettagli chimici teorici,le unità di misura più utilizzate sono: 1)Molarità M 2)Normalità N 3)%in peso 4)g/L 5)ppm e 6)Rapporto n:n. Di seguito,senza darne spiegazione, si elencano le conversioni da una unità di misura all'altra per quanto riguarda le soluzioni che interessano l'analisi del suolo.
Esecuzione,Vetreria e Strumenti per Distillazione
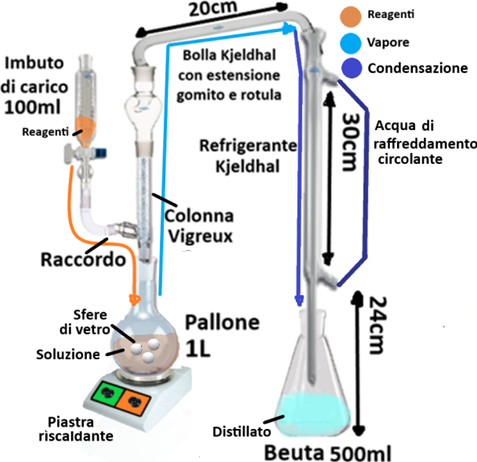
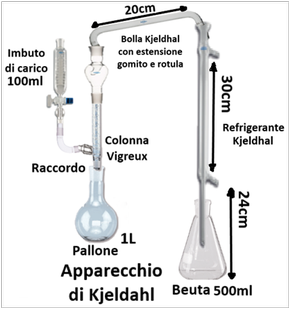
Nell'analisi del suolo la distillazione avviene principalmente tramite una apparecchiatura opportunamente assemblata che prende il nome di Apparecchio di Kjeldhal. Esso è costituito da 1 imbuto di carico da 100ml provvisto di rubinetto collegato a una colonna Vigreux tramite un raccordo. La colonna si colllega a sua volta ad un refrigerante Kjeldhal tramite una estensione a gomito. Alle estremità si hanno un pallone da 1L contenente la soluzione da distillare e comunicante con la colonna e una beuta da 500ml che raccoglie il distillato. La soluzione nel pallone viene riscaldata tramite una piastra elettrica e si inseriscono pezzetti di pomice o palline di vetro per evitare schizzi.E' importante che i vari pezzi siano montati alle distanze e altezze opportune in modo che la distillazione avvenga adeguatamente e si eviti la fuoriuscita di Acido solforico,che è il reagente principale utilizzato ed è estremamente corrosivo. Il refrigerante è una sorta di serpentina in vetro in cui si fa circolare acqua piuttosto fresca (in alternativa si può avvolgere in un panno umido molto freddo). In commercio esistono Apparecchi di Kjeldhal già assemblati.
Strumenti per la determinazione del pH

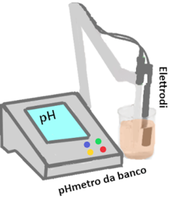

Il pH definisce se una sostanza ha un carattere acido oppure il suo contrario,cioè basico (o alcalino). L'acqua distillata ha invece pH neutro,cioè 7. La misura del pH si ottiene immergendo in soluzione acquosa del campione un pezzetto di cartina indicatrice,un pHmetro digitale oppure gli elettrodi di un pHmetro da banco. Gli strumenti vanno periodicamente tarati con soluzioni a pH noto e costante dette soluzioni tampone,che si possono acquistare già pronte o si possono preparare (in genere si utilizzano tamponi a pH=4,pH=7 e pH=9). Gli elettrodi del pHmetro da banco vanno tenuti immersi dopo l'uso in acqua distillata per non far seccare le membrane interne.
Strumenti per analisi spettroscopica
Oggigiorno l’analisi tramite spettroscopia è ampiamente diffuso e,nonostante possa sembrare una tecnica complessa,in realtà si basa su concetti e strumentazioni piuttosto semplici. Quando un fascio di luce attraversa una sostanza,parte della luce viene assorbita e questa quantità viene appunto misurata da uno spettrometro. Ovviamente l’entità dell’assorbimento dipende dalla concentrazione della sostanza in esame e questo permette quindi di ricavarne la quantità proporzionalmente alla luce che viene assorbita,definita da un parametro detto Assorbanza A. La spettoscopia si presta perfettamente per l’analisi di sostanze presenti in un campione con basse concentrazioni;in caso contrario il campione viene diluito.

Nello spettrometro viene inserito un contenitore detto cuvetta o cella contenente una soluzione dell'elemento in esame. Si inserisce una lampada specifica per l'elemento considerato che emette un fascio di luce ad una determinata lunghezza d'onda. In genere tuttavia lo strumento è già dotato di una lampada alogena al tungsteno che copre una lunghezza d'onda ampia da 340 a 900nm. Il campione assorbe parte del fascio di luce e lo spettrometro fornisce un valore detto Assorbanza A. Misurando l'assorbanza di più soluzioni a concentrazione nota dette soluzioni standard si può costruire una Retta di taratura,cioè un grafico che riporta sull'asse orizzontale i valori delle concentrazioni e sull'asse verticale i valori delle assorbanze per ogni soluzione standard. Si misura quindi con lo spettrometro il valore dell'assorbanza della soluzione del campione in esame e per estrapolazione della retta di taratura si ricava la concentrazione e di conseguenza la quantità dell'elemento presente nel campione.Poiché il raggio di luce che attraversa la cella contenente il campione viene in parte assorbito,oltre che dalla sostanza in esame nel campione,anche dal solvente e dai reagenti chimici in cui la si è disciolta,l’assorbanza viene misurata anche per un bianco, cioè una cella che contiene una soluzione con tutti i solventi e i reagenti tranne il campione.In teoria il valore di assorbanza del bianco dovrebbe essere circa 0.
Le soluzioni standard si possono acquistare e sono da diluire;alcune si possono trovare già pronte a determinate concentrazioni.
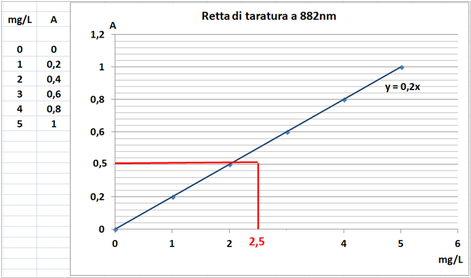
Retta di Taratura - si ipotizzi di voler determinare spettroscopicamente la concentrazione di molibdeno in una soluzione acquosa di campione di terra.Si misura con lo spettrometro l'assorbanza di 4 soluzioni standard contenenti rispettivamente 0,1,3,e 5 mg/L e si seleziona una lunghezza d'onda per il molibdeno che corrisponde a 882nm. Si ammetta che il valore dell'assorbanza misurato per le 4 soluzioni sia quello rappresentato in tabella. Allo stesso modo si misura l'assorbanza del bianco che si ammette pari a 0.Si disegna la retta di taratura con le coordinate ottenute (possibilmente è preferibile utilizzare un grafico ottenuto da un pc).Si misura infine il valore dell'assorbanza della soluzione acquosa di campione di terra e si ammetta che sia pari a 0,85.Per estrapolazione si ottiene che il campione contiene 3,58mg/L di molibdeno.

Le analisi spettroscopiche utilizzate per l’analisi del suolo e dell’acqua vengono principalmente suddivise in base a due differenti tecniche che si basano sugli stessi concetti ma con strumenti spettroscopici leggermente diversi:
Colorimetria AAS:si utilizzano colorimetri che presentano come sorgente di luce una normale lampada a incandescenza.Il metodo si presta all’analisi di sostanze colorate o che sono rese colorate tramite specifiche reazioni con opportuni reagenti.
Spettrometria di Assorbimento a fiamma F-AAS: si utilizzano spettrofotometri in cui la soluzione da analizzare viene nebulizzata tramite il calore di una fiamma. Il vapore viene poi attraversato da un fascio di luce emesso da una lampada. La fiamma viene prodotta da un bruciatore alimentato da un gas comburente(aria) e un gas combustibile (Acetilene) oppure per via elettrotermica tramite un Fornetto di Grafite.
La Spettroscopia F-AAS è la tecnica maggiormente utilizzata per gli elementi metallici;tuttavia sono oggi disponibili anche semplici spettrometri AAS per la determinazione di praticamente tutti gli elementi.Gli spettrofotometri F-AAS rispetto a quelli AAS sono più costosi e richiedono il poco agevole utilizzo di gas.
I Reagenti
 Le sostanze liquide o solide utilizzate nelle analisi chimiche si chiamano Reagenti. I reagenti liquidi si acquistano concentrati per poi quasi sempre diluirli. I reagenti concentrati sono molto pericolosi da utilizzare ed è quindi consigliabile acquistare quantitativi minimi. Naturalmente occorre molta prudenza nel maneggiarli;una goccia di acido solforico o di idrossido di sodio è in grado di corrodere irrimediabilmente un occhio.Conseguentemente risulta tassativo l'utilizzo di occhiali protettivi,un camice e guanti. I reagenti si conservano al riparo dalla luce e calore in contenitori di vetro tranne le
Le sostanze liquide o solide utilizzate nelle analisi chimiche si chiamano Reagenti. I reagenti liquidi si acquistano concentrati per poi quasi sempre diluirli. I reagenti concentrati sono molto pericolosi da utilizzare ed è quindi consigliabile acquistare quantitativi minimi. Naturalmente occorre molta prudenza nel maneggiarli;una goccia di acido solforico o di idrossido di sodio è in grado di corrodere irrimediabilmente un occhio.Conseguentemente risulta tassativo l'utilizzo di occhiali protettivi,un camice e guanti. I reagenti si conservano al riparo dalla luce e calore in contenitori di vetro tranne le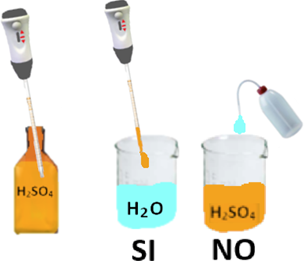
basi che si conservano in contenitori
di materiale plastico. Inoltre occorre sottolineare che molti reagenti emanano vapori irritanti e molto maleodoranti (nei laboratori si lavora infatti spesso sotto cappa aspirante).I reagenti liquidi si prelevano con una pipetta graduata. Nonostante i pittogrammi di pericolo,i reagenti liquidi sono spesso,ma non sempre, assai più pericolosi di quelli solidi in polvere.Estremamente importante è avere particolare cautela nel diluire i reagenti concentrati,in particolare l'acido solforico;la regola consiste nell'aggiungere piccole porzioni,anche goccia a goccia,di sostanza concentrata in molta più acqua e non viceversa. Se,per esempio, erroneamente si versano gocce d'acqua in un certo quantitativo di acido solforico,si ha una reazione che produce molto calore e che può essere anche esplosiva o comunque provocare schizzi di acido molto pericolosi.
Pulizia della vetreria- si esegue lavando con normale acqua del rubinetto e risciacquando alla fine con un pò di acqua distillata per evitare che si formino macchie di calcare sul vetro.
Solventi
 Acqua distillata - è il solvente necessario e il più utilizzato per sciogliere i reagenti solidi e diluire quelli liquidi. L'acqua del rubinetto non è utilizzabile poichè contiene calcare e altri composti che interferiscono con le analisi. L'acqua distillata si acquista comunemente nei supermercati,poichè è quella usata per i ferri da stiro o per le batterie delle auto. In genere si conserva in bidoni con rubinetto e si utilizza in spruzzette.
Acqua distillata - è il solvente necessario e il più utilizzato per sciogliere i reagenti solidi e diluire quelli liquidi. L'acqua del rubinetto non è utilizzabile poichè contiene calcare e altri composti che interferiscono con le analisi. L'acqua distillata si acquista comunemente nei supermercati,poichè è quella usata per i ferri da stiro o per le batterie delle auto. In genere si conserva in bidoni con rubinetto e si utilizza in spruzzette.Se non utilizzata per lungo tempo assorbe anidride carbonica dall'aria e deve quindi essere gettata.

Etanolo - è semplicemente alcool etilico ossia quello utilizzato per i liquori (non quello rosso per disinfettare)e si trova nei supermercati.
Ovviamente si incendia facilmente se a contatto con fiamme libere.
Trietanolammina - Si trova anche in commercio già pronta.
0,1M

Acidi
Acido acetico glaciale- liquido da acquistare in concentrazione al 99%.Emana un fortissimo odore penetrante ed irritante di aceto. Le altre concentrazioni da utilizzare per l'analisi del suolo sono:
Acido acetico al 96%- Si trova anche in commercio già pronto.
Acido acetico 0,1N(=0,1M) - si ottiene in un matraccio da 1L diluendo 6ml di Acido acetico al 96% con acqua distillata fino al volume di 1L. Si trova anche in commercio già pronto.
Acido acetico 0,25N(=0,25M) - si ottiene in un matraccio da 1L diluendo 15ml di Acido acetico al 96% con acqua distillata fino al volume di 1L.
Acido acetico al 2,5%(=0,45M) - si ottiene in un matraccio da 1L diluendo 27ml di Acido acetico al 96% con acqua distillata fino al volume di 1L.
Acido acetico 100ml/L (=1,75M) si ottiene in un matraccio da 1L diluendo 100ml di Acido acetico al 96% con acqua distillata fino al volume di 1L.
Acido acetico 1:10v/v(=1,6M)- si ottiene in un matraccio da 1L diluendo 100ml di Acido acetico al 99% con acqua distillata fino al volume di 1L.
Acido cloridrico - liquido da acquistare in concentrazione al 37%.Emana vapori pungenti ed irritanti di cloro ed è molto corrosivo. Le altre concentrazioni da utilizzare per l'analisi del suolo sono:
Acido cloridrico 1N(=1M) - si ottiene in un matraccio da 1L diluendo 83ml di Acido cloridrico al 37% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido cloridrico 200ml/L (=6,5M)- si ottiene in un matraccio da 1L diluendo 200ml di Acido cloridrico al 37% con acqua distillata fino al volume di 1L.
Acido cloridrico 100ml/L (=3,25M)- si ottiene in un matraccio da 1L diluendo 100ml di Acido cloridrico al 37% con acqua distillata fino al volume di 1L.
Acido cloridrico 10ml/L (=0,3M)- si ottiene in un matraccio da 1L diluendo 10ml di Acido cloridrico al 37% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido cloridrico 1:1 v/v(=6M) - si ottiene in un matraccio da 100L diluendo 500ml di Acido cloridrico al 37% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido nitrico - liquido da acquistare in concentrazione al 65%. Molto corrosivo.
Acido nitrico 5N(=5M) - si ottiene in un matraccio da 1L diluendo 345ml di Acido nitrico al 65% con acqua distillata fino al volume di 1L.
Acido nitrico 10ml/L (=0,2M) - si ottiene in un matraccio da 1L diluendo 10ml di Acido nitrico al 65% con acqua distillata fino al volume di 1L.
Acido nitrico 1:1v/v (=7,27M)- si ottiene in un matraccio da 1L diluendo 500ml di Acido nitrico al 65% con 500m di acqua distillata.
Acido solforico - liquido da acquistare in concentrazione al 96%. Molto corrosivo e reagisce con l'acqua sviluppando calore. Da manipolare con molta prudenza.
Acido solforico al 22%(=8N=4M) - si ottiene in un matraccio da 1L diluendo 230ml di Acido solforico al 96% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 5N(=2,5M) - si ottiene in un matraccio da 1L diluendo 140ml di Acido solforico al 96% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 2N(=1M) - si ottiene in un matraccio da 1L diluendo 56ml di Acido solforico al 96% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 1N(=0,5M) - si ottiene in un matraccio da 1L diluendo 28ml di Acido solforico al 96% con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 0,02N(=0,01M) - si ottiene in un matraccio da 1L diluendo 0,6ml di Acido solforico al 96% (oppure 20ml di acido 1N) con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 0,01N(=0,005M) - si ottiene in un matraccio da 1L diluendo 0,3ml di Acido solforico al 96% (oppure 10ml di acido 1N) con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Acido solforico 1:10 v/v(=0,7M) - si ottiene in un matraccio da 1L diluendo 100ml di Acido solforico al 96% con acqua distillata fino al volume di 1L.
Acido fosforico - liquido da acquistare in concentrazione all' 85%.Molto corrosivo.
Acido ossalico diidrato - cristalli bianchi
Acido ossalico 0,2M (=0,4N) - trasferire 52,21g di acido ossalico diidrato in un matraccio da 1L e portare a volume di acqua distillata.
Acido borico - cristalli bianchi
Acido borico 30g/L (=0,5M) - trasferire 30g di acido borico in un becker da 1L con 500ml di acqua distillata,bollire e mescolare. Trasferire in un matraccio da 1L e portare a volume di acqua distillata.
Acido ascorbico 0,1M - Non è altro che vitamina C.Si ottiene in un matraccio da 100ml sciogliendo 1,76g di Acido ascorbico solido con acqua distillata fino al volume di 100ml.
Acido nitrilotriacetico 99%

Basi
Idrossido d'ammonio - liquido da acquistare in concentrazione al 30%. E' ammoniaca solubilizzata in acqua.Ha un fortissimo odore penetrante ed irritante.
Idrossido d'ammonio 1:1 v/v(=3,8M) - si ottiene in un matraccio da 200ml diluendo 100ml di ammonio idrossido al 30% con acqua distillata fino al volume di 200ml.
Idrossido d'ammonio 1:10 v/v (=0,7M)- si ottiene in un matraccio da 1L diluendo 100ml di ammonio idrossido al 30% con acqua distillata fino al volume di 1L.
Idrossido di sodio - liquido da acquistare in concentrazione 1M(1N) oppure in forma solida. E' estremamente corrosivo ed è noto anche come Soda caustica.
Idrossido di sodio 0,02M(=0,02N) - si ottiene in un matraccio da 1L diluendo 20ml di sodio idrossido 1M con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Idrossido di sodio 300g/L(=7,5M=7,5N) - si ottiene in un matraccio da 1L sciogliendo 300g di sodio idrossido solido con acqua distillata fino al volume di 1L.
Idrossido di sodio 100g/L (=2,5M)- si ottiene in un matraccio da 1L sciogliendo 100g di sodio idrossido solido con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Perossido d'idrogeno 30% (110volumi) - Si trova anche in commercio già pronto. Non è altro che acqua ossigenata concentrata. La sua concentrazione lo rende corrosivo e poichè tende a rilasciare ossigeno deve essere conservato lontano da luce e calore poichè potenzialmente esplosivo.

Sali
Alluminio solfato
Soluzione 100g/L (=0,15M) - si ottiene in un matraccio da 1L sciogliendo 100g di Alluminio solfato solido con acqua distillata fino al volume di 1L.
Ammonio cloruro
Soluzione 100g/L (=1,87M) - si ottiene in un matraccio da 1L sciogliendo 100g di Ammonio cloruro solido con acqua distillata fino al volume di 1L.
Ammonio molibdato tetraidrato
Soluzione 40g/L (=0,03M) - si ottiene in un matraccio da 1L sciogliendo 40g di Ammonio molibdato tetraidrato solido con acqua distillata fino al volume di 1L.Conservare in bottiglia scura.
Ammonio ossalato monoidrato
Soluzione 0,1M (=0,2N)- si ottiene in un matraccio da 1L sciogliendo 14,212g di Ammonio ossalato monoidrato solido con acqua distillata fino al volume di 1L.
Soluzione 0,2M - si ottiene in un matraccio da 1L sciogliendo 28,42g di Ammonio ossalato monoidrato solido con acqua distillata fino al volume di 1L.
Antimonio potassio tartrato
Soluzione 1mg/ml (=0,4M)- si ottiene in un matraccio da 100 ml sciogliendo 0,273g di Antimonio potassio tartrato solido con acqua distillata fino al volume di 100 ml .
Bario cloruro diidrato
Soluzione 0,41M - si ottiene in un matraccio da 200 ml sciogliendo 20g di Bario cloruro diidrato solido con acqua distillata fino al volume di 200 ml.
Potassio bicromato
Soluzione 0,167 M - si ottiene in un matraccio da 1L sciogliendo 49,032g di Potassio bicromato solido essicato in stufa a 105°C con acqua distillata fino al volume di 1L.
Soluzione 0,1 M -si ottiene in un matraccio da 1L sciogliendo 29,42g di Potassio bicromato solido essicato in stufa a 105°C con acqua distillata fino al volume di 1L.
Calcio cloruro diidrato
Soluzione 0,1 M - si ottiene in un matraccio da 1L sciogliendo 147,g di Calcio cloruro diidrato solido con acqua distillata fino al volume di 1L. Conservare in bottiglia di plastica.
Soluzione 0,01 M - si ottiene in un matraccio da 1L sciogliendo 1,47g di Calcio cloruro diidrato solido con acqua distillata fino al volume di 1L. Conservare in bottiglia di plastica.
Ferro solfato eptaidrato
Soluzione 0,5 M - si ottiene in un matraccio da 1L sciogliendo 139g di Ferro solfato eptaidrato solido con acqua distillata fino al volume di 1L.
Ferro ammoniosolfato esaidrato
Soluzione 0,5 M - si ottiene in un matraccio da 1L sciogliendo 196,06g di Ferro ammoniosolfato esaidrato solido in 600ml di con acqua distillata. Aggiungere a piccole porzioni 16ml di Acido solforico 96% ed aggiungere acqua distillata fino al volume di 1L. La soluzione si conserva per poco tempo.
Permanganato di potassio
Soluzione 0,1 M(=0,5N)- si ottiene in un matraccio da 1L sciogliendo 15,8g di Permanganato di potassio solido con acqua distillata fino al volume di 1L.
Soluzione 0,02 M (=0,1N) - si ottiene in un matraccio da 1L sciogliendo 3,161g di Permanganato di potassio solido con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
0,33 M
p-Nitrofenolo
Soluzione allo 0,25%(=1,8M)- si ottiene in un matraccio da 100ml sciogliendo 0,25 g di p-Nitrofenolo solido con acqua distillata fino al volume di 100ml.

Molibdato sodico
Potassio cloruro
Soluzione 2M - si ottiene in un matraccio da 1L sciogliendo 149,1 g di Cloruro di Potassio solido con acqua distillata fino al volume di 1L.
Soluzione 0,1M - si ottiene in un matraccio da 1L sciogliendo 7,455 g di Cloruro di Potassio solido con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronto.
Soluzione 0,02M - si ottiene in un matraccio da 1L sciogliendo 1,49g di Cloruro di Potassio solido con acqua distillata fino al volume di 1L.
Soluzione 0,002M - si ottiene in un matraccio da 1L sciogliendo 0,149g di Cloruro di Potassio solido con acqua distillata fino al volume di 1L.
Soluzione 10g/L (=0,13M)- si ottiene in un matraccio da 1L sciogliendo 10g di Cloruro di Potassio solido con acqua distillata fino al volume di 1L.
Magnesio ossido
Sodio carbonato monoidrato
Sodio bicarbonato 0,5M - si ottiene in un matraccio da 1L sciogliendo 42g di Sodio bicarbonato solido in 900ml d'acqua distillata e aggiungendo Sodio idrossido 1M goccia a goccia fino a pH 8,5.
Lega di Devarda - E' un composto costituito da Rame-Alluminio-Zinco in rapporto 10:9:1.
Sodio esametafosfato 50g/L- in un becker da 500 ml si trasferiscono 250 ml di acqua distillata,40 g di sodio esametafosfato e 10 g di Carbonato di sodio monoidrato. Mescolare fino a dissoluzione completa e trasferire in un matraccio da 1L.Portare a volume con acqua distillata
Bicarbonato d’ammonio
DTPA (Acido dietilentriamminopentacetico)
Soluzione 0,005M
EDTA
Soluzione 0,025M - si ottiene in un matraccio da 1L sciogliendo 9,305 g di EDTA sodico solido con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronta.
Soluzione 0,02M
Carbone attivo
Ammonio acetato 0,5M
Potassio acetato
Calcio solfato diidrato
Soluzione satura - si ottiene in un matraccio da 1L sciogliendo 5 g di Calcio solfato diidrato solido con acqua distillata fino al volume di 1L. Agitare per 1 ora,lasciar riposare una notte e filtrare.
Lantanio nitrato esaidrato
Soluzione 20g/L- si ottiene in un matraccio da 1L sciogliendo 62,34g di Lantanio nitrato esaidrato solido con Acido nitrico fino al volume di 1L.
Argento solfato
Magnesio solfato eptaidrato -
Soluzione 0,05M - si ottiene in un matraccio da 1L sciogliendo 12,324 g di Magnesio solfato eptaidrato solido con acqua distillata fino al volume di 1L.
Ammonio acetato 0,5M
Magnesio cloruro esaidrato -
Soluzione 2g/L - si ottiene in un matraccio da 1L sciogliendo 2 g di Magnesio cloruro esaidrato solido con acqua distillata fino al volume di 1L.
Superfloc - è un agente flocculante utilizzato per chiarificare l'acqua delle piscine.

Soluzioni Tampone
Sono soluzioni che permettono di mantenere il pH ad un certo valore. Si utilizzano anche per tarare i pHmetri.


Indicatori
Sono sostanze che cambiano colore a seconda delle caratteristiche di una soluzione,per es. quando il pH da acido diventa basico o viceversa.i acido base in matraccio da 100ml sciogliere 99mg di e 66mg di rosso metile e poratre a volume

con etanolo
Verde di Bromocresolo - in un matraccio da 100ml sciogliere 0,1g di verde bromocresolo e portare a volume con etanolo.
Fenolftaleina - In un matraccio da 100ml sciogliere 0,1g di fenolftaleina e portare a volume con etanolo
Rosso metile - In un matraccio da 100ml sciogliere 0,1g di fenolftaleina e portare a volume con etanolo.
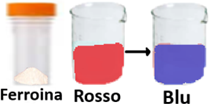
Ferroina - preparata combinando fenantrolina con solfato ferroso in acqua.
Nero Ericromo T-miscelare 20g di Cloruro di sodio con 0,2g di Nero Eriocromo T
 Soluzioni Standard
Soluzioni StandardSono soluzioni a concentrazione nota e molto accurata che vengono utilizzate,dopo diluizione,per costuire le rette di taratura in spettrometria.Sono necessariamente da acquistare,in genere alla concentrazione di 1000 ppm.
Esecuzione delle Analisi e Valutazione dei risultati
Operazioni preliminari
Campionamento


Per ottenere un campione da analizzare si comincia con il prelevare in campo porzioni di terreno scavando con una vanga dopo aver eliminato l’eventuale manto erboso. Si prelevano ‘’fette’’ verticali di terreno o,meglio ancora, carote di terreno prelevate con una trivella. Il prelievo delle porzioni si esegue in zone che siano il più possibile simili per aspetto e condizioni fisiche,per esempio da aree tutte esposte al sole,senza ristagni idrici,ecc. La profondità di scavo non deve essere né troppo superficiale né troppo profonda;il numero delle porzioni da prelevare sono di solito 10 da 50 g ciascuna. Le varie porzioni si introducono in secchio per poi essere rovesciate su un telo fino ad ottenere 500 g di terra che va poi ben mescolata. Ovviamente i quantitativi possono anche essere superiori.
Preparazione di terra fine
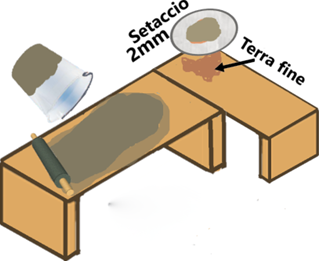
Il campione prelevato in campo si mescola e si stende per uno spessore di 1-2cm su un banco ben pulito, e si lascia asciugare a temperatura ambiente. Successivamente si frantuma la terra il più possibile con un mattarello e si passa al setaccio con maglie di 2mm. Dalla setacciatura si devono ottenere almeno 300g di terra fine.
Nelle analisi,ciò che interessa è la terra e non i residui vegetali o altro in essa contenuti.Di conseguenza occorre eliminarli.
Essiccazione del campione da analizzare
Prima di procedere alle analisi,il campione di terra fine deve essere completamente anidro e la massa del contenitore per pesarlo deve essere nota con accuratezza. Il procedimento è stato descritto in precedenza e i risultati da considerare sono quelli ottenuti per ripetuta essiccazione in stufa fino a massa costante.
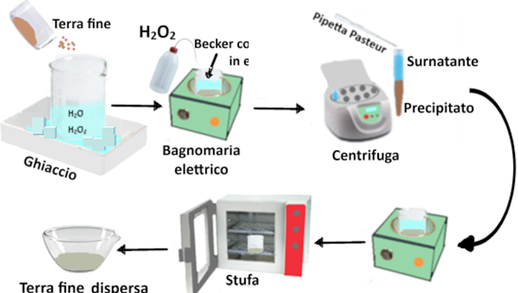
Il campione di terra fine (20g) si trasferisce in un becker da 1L contenente 15 ml di acqua distillata. Si aggiungono 15 ml di acqua ossigenata 30%m/m e si mescola con una bacchetta di vetro. Se si forma schiuma, si pone il becker in una vaschetta con ghiaccio e si aggiunge acqua ossigenata finchè la schiuma scompare.Lasciare riposare per una notte e scaldare a bagnomaria a 80-90°C aggiungendo porzioni di acqua ossigenata fino a quando si ha una soluzione piuttosto limpida.Dopo l’ultima aggiunta,addizionare acqua distillata fino al volume di 300ml e continuare il riscaldamento per 1 ora.Trasferire il tutto in una provetta da centrifuga da 250ml, centrifugare ed eliminare il liquido sovrastante (il surnatante)con una pipetta Pasteur.
Si trasferisce il campione centrifugato in un becker da 500ml e si scalda a bagnomaria fino a secchezza. Si lascia seccare ulteriormente in stufa a 105°C,si raffredda e si pesa.La terra fine dispersa così ottenuta è quella che viene utilizzata per le analisi.
Determinazione della tessitura del terreno
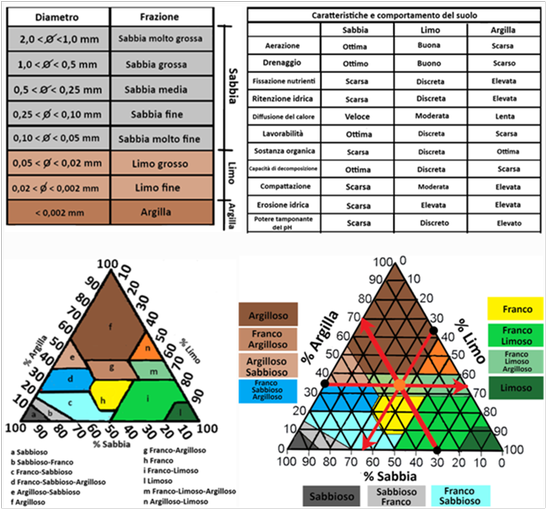 La tessitura è un parametro fondamentale che descrive la composizione dimensionale delle particelle costituenti il terreno. Le particelle con grandezza minore di 2mm costruiscono la terra fine a sua volta frazionabile in particelle di grandezza minore elencate in tabella. Per determinare la tessitura di un terreno ci si avvale del cosiddetto triangolo tessiturale ai cui lati sono riportati i valori percentuali di sabbia, limo ed argilla.All’interno sono delineate una serie di aree, ognuna delle quali rappresenta un determinata classe di particelle. La tessitura è responsabile di molte proprietà fisico-chimiche del suolo e da essa derivano le eventuali operazioni di ammendamento, concimazione e irrigazione del terrreno.
La tessitura è un parametro fondamentale che descrive la composizione dimensionale delle particelle costituenti il terreno. Le particelle con grandezza minore di 2mm costruiscono la terra fine a sua volta frazionabile in particelle di grandezza minore elencate in tabella. Per determinare la tessitura di un terreno ci si avvale del cosiddetto triangolo tessiturale ai cui lati sono riportati i valori percentuali di sabbia, limo ed argilla.All’interno sono delineate una serie di aree, ognuna delle quali rappresenta un determinata classe di particelle. La tessitura è responsabile di molte proprietà fisico-chimiche del suolo e da essa derivano le eventuali operazioni di ammendamento, concimazione e irrigazione del terrreno.Il triangolo tessiturale viene utilizzato in questo modo: si calcola chimicamente la percentuale di sabbia,limo e argilla presente nel terreno e dal triangolo si estrapola la precisa tessitura. Per es. se la percentuale di sabbia è il 30%,quello di limo il 35% e quello di argilla il 35%,tracciandone i punti sul grafico e le rette nelle orientazioni illustrate,si ottiene una tessitura Franco-Argillosa.
Analisi empirica - Tecnica del nastro
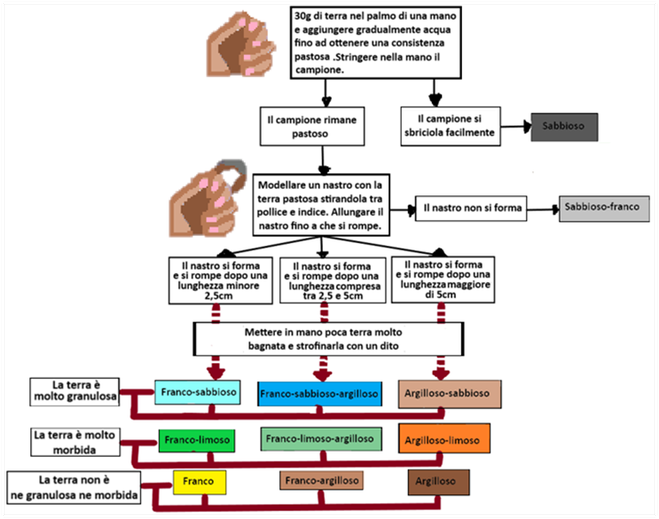
E' una tecnica,che se ben eseguita,fornisce risultati utili senza ricorrrere all'analisi chimica. Il terreno può essere prelevato anche in superficie dopo aver eliminato la cotica erbosa.Il metodo è basato sulla semplice osservazione visiva di un pugno di terra inumidito e sulla modellazione di un nastro di terra. La tecnica ha lo svantaggio di richiedere una valutazione soggettiva ed una manualità che non sempre è agevole. Al risultato si perviene attraverso uno schema mostrato a fianco che tecnicamente si definisce una ''chiave dicotomica''.
Analisi chimica - Metodo della pipetta
Reagenti:
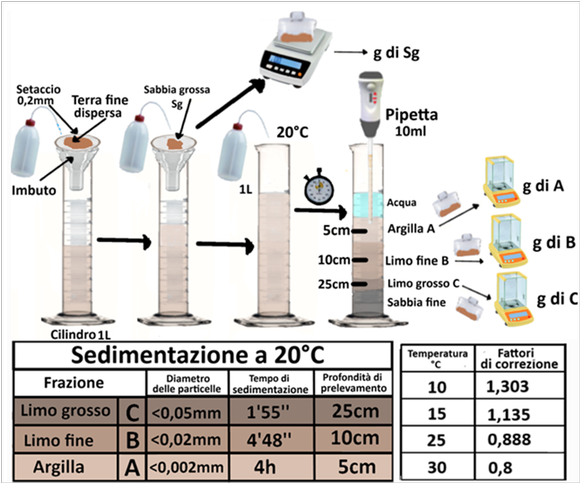
- Soluzione di Sodio esametafosfato 50g/L
In un cilindro da 1L,trasferire 10 ml della soluzione di sodio esametafosfato e 10g di terra fine dispersa (se si ritiene argillosa;30g se di medio impasto e 90g se sabbiosa) facendola passare al setaccio da 0,2mm. Lavare i residui sul setaccio con acqua distillata portata alla temperatura di sedimentazione come in seguito descritta (per es. 20°C) e aggiungere l’acqua di lavaggio al cilindro finchè diventa limpida. Trasferire il materiale sul setaccio in un pesafiltri, far evaporare a bagnomaria,essiccare in stufa a 105°C, raffreddare e pesare registrando il valore della massa Sg.
Portare a volume di 1L (Vt) la sospensione nel cilindro con acqua distillata. Agitare la sospensione e tenere in ambientetermostatato,per es.alla temperatura di 20°C.
Al tempo opportuno per ogni frazione di particelle (variabile a seconda della temperatura di sedimentazione), prelevare con una pipetta un volume noto Vp (in genere 10ml)un campione della sospensione e trasferirlo in un becker di massa nota.La profondità del prelevamento con la pipetta si calcola a partire dalla superficie della sospensione e dopo ogni prelevamento la profondità si calcola a partire dalla nuova superficie.Lasciar evaporare a bagnomaria, essiccare in stufa a 105°C, raffreddare in essiccatore e pesare (necessita bilancia analitica).
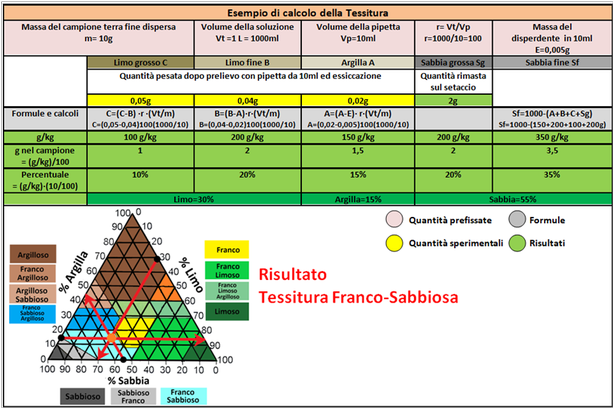 Per il calcolo delle quantità delle diverse frazioni in g/Kg si utilizzano le formule:
Per il calcolo delle quantità delle diverse frazioni in g/Kg si utilizzano le formule:Sabbia grossa = (Sg·1000)/m
Limo grosso = (C-B)·r·(Vt/m)
Limo fine = (B-A)·r·(Vt/m)
Argilla = (A-E)·r·(Vt/m)
Sabbia fine = 1000 – massa totale delle altre frazioni
Dove: Sg = massa di sabbia grossa
C = massa di limo grosso
B = massa di limo fine
A = massa di argilla
E = quantità di sodio esametafosfato nel volume di sospensione prelevata. Per 50g/L e pipetta da 10ml vale 0,005g
m = massa di terra fine dispersa
r = Vt/Vp (Vt=volume cilindro e Vp = volume prelevato con la pipetta)
Determinazione del pH del terreno
Il pH fornisce il valore dell'acidità,neutralità o basicità del terreno. Un pH più o meno acido assume valori da 0 a 6,9;un pH più o meno basico (o alcalino) assume valori da 7,1 a 14; il pH è neutro se ha un valore pari a 7 ed è pari al valore di quello dell'acqua distillata. Da un punto di vista agrario si è soliti classificare il pH come acido(da 4,5 a 5,9),subacido(da 6,0 a 6,7 ),neutro(da 6,8 a 7,2)subalcalino(da 7,3 a 8,1) e alcalino(maggiore di 8,2).
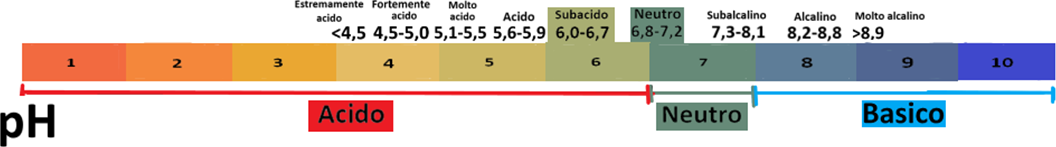
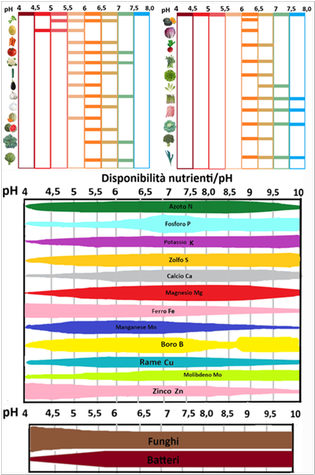 In genere le piante orticole preferiscono un pH da 6 a 7, ossia subacido o neutro. Si dicono calciofile o basofile le piante che prediligono un pH piuttosto alcalino e acidofile o ossifile quelle che prediligono un pH piuttosto acido. Sono neutrofile le piante che prediligono un pH=7. La determinazione del pH del terreno è molto importante poichè fornisce indicazioni sulla tessitura del terreno (in genere sono alcalini i terreni ricchi di calcare,acidi quelli torbosi), sulle eventuali correzioni da effettuare con ammendanti e sulla capacità del terreno di rendere disponibili alle piante gli elementi nutritivi.
In genere le piante orticole preferiscono un pH da 6 a 7, ossia subacido o neutro. Si dicono calciofile o basofile le piante che prediligono un pH piuttosto alcalino e acidofile o ossifile quelle che prediligono un pH piuttosto acido. Sono neutrofile le piante che prediligono un pH=7. La determinazione del pH del terreno è molto importante poichè fornisce indicazioni sulla tessitura del terreno (in genere sono alcalini i terreni ricchi di calcare,acidi quelli torbosi), sulle eventuali correzioni da effettuare con ammendanti e sulla capacità del terreno di rendere disponibili alle piante gli elementi nutritivi. Il pH influenza anche l'attività della microfauna del terreno,ossia la capacità di microrganismi come batteri e funghi di decomporre le sostense nutritivie in sostanze più semplici assimilabili dalle piante.La reazione acida riduce l' attività batterica e favorisce la attività dei funghi.
Inoltre i terreni troppo acidi causano un elevato assorbimento di alluminio che diventa tossico per le piante. Occorre quindi intervenire con calce che neutralizza l'eccesso di acidità.
Analisi empirica - Misura con cartina indicatrice
 Si setaccia un campione di terreno a 2mm in modo da ottenerne 30g e si introduce in un recipiente con 30g (=30ml)di acqua distillata (l’importante è che il rapporto terra/acqua sia 1:1).Si agita per diverse volte dopo aver chiuso il recipiente e si lascia decantare per diversi minuti. Si introduce un pezzetto di cartina indicatrice nel surnatante e si valuta il pH per comparazione tra il colore che assume la cartina e quello riportato sulla confezione della cartina.
Si setaccia un campione di terreno a 2mm in modo da ottenerne 30g e si introduce in un recipiente con 30g (=30ml)di acqua distillata (l’importante è che il rapporto terra/acqua sia 1:1).Si agita per diverse volte dopo aver chiuso il recipiente e si lascia decantare per diversi minuti. Si introduce un pezzetto di cartina indicatrice nel surnatante e si valuta il pH per comparazione tra il colore che assume la cartina e quello riportato sulla confezione della cartina.Il limite del metodo,anche se del tutto applicabile,risenta della valutazione visiva soggettiva poichè non sempre è facile valutare i colori.
Analisi chimica - Misura con pHmetro
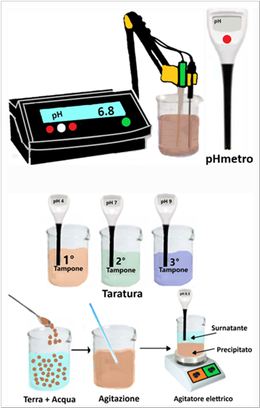 Per la misura esatta del pH ci si avvale dell'utilizzo di uno strumento denominato pHmetro che può essere in generale di due tipi:da banco e portatile. In entrambe i casi lo strumento deve essere tarato tramite apposite soluzione a pH noto denominate soluzioni tampone (acquistabili già pronte) e dopo l'uso le punte degli elettrodi vanno immerse in acqua distillata per non far seccare le membrane in essi contenuta. Oltre ad essere accurati,il valore del pH viene mostrato direttamente senza essere soggetto a valutazione visiva soggettiva.
Per la misura esatta del pH ci si avvale dell'utilizzo di uno strumento denominato pHmetro che può essere in generale di due tipi:da banco e portatile. In entrambe i casi lo strumento deve essere tarato tramite apposite soluzione a pH noto denominate soluzioni tampone (acquistabili già pronte) e dopo l'uso le punte degli elettrodi vanno immerse in acqua distillata per non far seccare le membrane in essi contenuta. Oltre ad essere accurati,il valore del pH viene mostrato direttamente senza essere soggetto a valutazione visiva soggettiva.Lo strumento viene tarato prima con un tampone a pH=4,poi con uno a pH=7 e infine con uno a pH=9. Tra una misurazione del pH e l'altra con le soluzioni tampone,lo strumento deve essere risciacquato con acqua distillata. Si introducono in un becker un campione di terra fine e acqua distillata in rapporto 1:2,5(per es. 1 grammo di terra e 2,5 grammi d'acqua),si agita e si lascia riposare per una notte. Infine si misura il pH con un pHmetro tarato tenendo la soluzione in agitazione.
Determinazione del fabbisogno in Calce
 Calcolato il pH del terreno,se questo è troppo acido lo si può correggere con Calce agricola come ammendante. La quantità di calce in grammi per metro quadrato di terreno per portare il pH a 6,6,4 o 6,8 si può consultare in tabella oppure estrapolando i grafici oppure tramite le equazioni rispettive.
Calcolato il pH del terreno,se questo è troppo acido lo si può correggere con Calce agricola come ammendante. La quantità di calce in grammi per metro quadrato di terreno per portare il pH a 6,6,4 o 6,8 si può consultare in tabella oppure estrapolando i grafici oppure tramite le equazioni rispettive. Per es. se il pH del terreno è 5,5 e lo si vuole portare a 6 occorrerano 198g di calce al metro quadro.
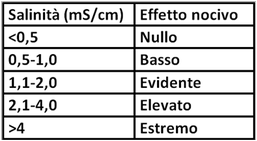
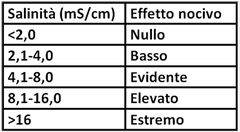
Determinazione della conduttività elettrica (Salinità)
I sali solubili presenti nel terreno,anche per effetto delle concimazioni e dell’ acqua di irrigazione se presenti in concentrazione eccessiva possono provocare fitotossicità. Una salinità elevata, con conseguente assorbimento di acqua per osmosi,causa una minore possibilità per le piante di assorbire acqua e sali minerali. Le orticole hanno una diversa sensibilità nei riguardi di una salinità elevata.
Analisi empirica - Estratto acqua/terra 2:1
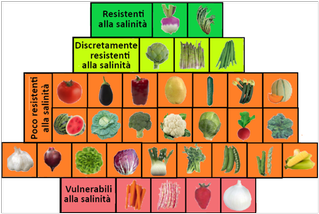
 Trasferire 100g di terra fine non essiccata in un becker da 500ml con 200ml di acqua distillata. Agitare per 2 ore e lasciar riposare una notte. Filtrare e misurare la conduttività a 25°C tramite un tester. Il valore si moltiplica per 2.
Trasferire 100g di terra fine non essiccata in un becker da 500ml con 200ml di acqua distillata. Agitare per 2 ore e lasciar riposare una notte. Filtrare e misurare la conduttività a 25°C tramite un tester. Il valore si moltiplica per 2.Analisi chimica - Pasta satura
Trasferire 100g di terra fine in una capsula di porcellana formando un cono e aggiungere acqua distillata goccia a goccia lungo la parete della capsula fino a bagnatura della terra. Coprire la capsula a lasciar riposare una notte. Mescolare la terra pastosa con una spatola ed ottenere una pasta fluida aggiungendo terra o acqua. Filtrare e aggiungere al surnatante una goccia di sodio esametafosfato allo 0,1% per ogni 25ml di liquido. Misurare direttamente la conduttività a 25°C tramite un tester.
I valori di conduttività si riportano in dS/m.
Determinazione del Calcare attivo
In realtà non si tratta di calcolare la quantità di calcare (cioè carbonato di calcio)ma la quantità di ioni calcio liberata dai suoi sali (per es. nitrato di calcio,solfato di calcio,ecc.). Il calcare rende meno assimilabile il fosforo e i microelementi e altera la tessitura del terreno.
Analisi empirica - Effervescenza
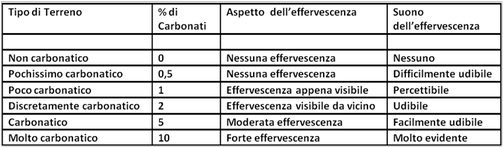

Il metodo è basato sulla semplice osservazione visiva e uditiva data dallo svilupparsi o meno di effervescenza di un campione di terreno trattato con Acido cloridrico. L'effervescenza è dovuta ad una reazione chimica che libera anidride carbonica.
Si tratta un piccolo campione di terreno con qualche goccia di Acido cloridrico 1N (acquistabile e dove 1N è la concentrazione definita come 1 Normale) e si osserva se si sviluppano bollicine e si sente un tipico suono di effervescenza.
Analisi chimica - Titolazione
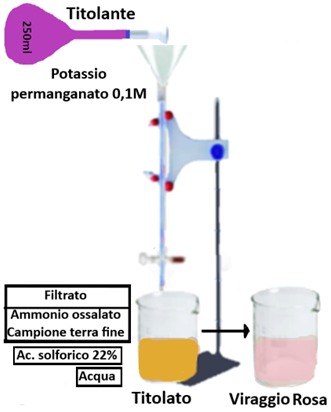
Reagenti:
- Soluzione di Acido solforico al 22%.
- Soluzione di Permanganato di potassio 0,1M (=0,5N)
- Soluzione di Ammonio ossalato 0,1M
Porre 10 g di terra fine dispersa in un matraccio da 250ml e portare a volume con la soluzione di ammonio ossalato.Tenere in agitazione per 2 ore,filtrare in un becker da 250ml e trasferire 20ml di filtrato in un becker da 250ml con una pipetta.Addizionare 60 ml di acqua distillata e 10ml di Acido solforico al 22%.
Titolare a 70°C con la soluzione di Permanganato di potassio.
La titolazione si interrompe alla comparsa di colore rosa persistente. Eseguire la medesima titolazione in bianco.La quantità in percentuale di calcare attivo si calcola tramite la formula:C%=(B-A)·0,001·N·50·(V1/V2)·m
Dove C=% di calcare attivo
B= ml di permanganato di potassio consumati per la prova in bianco
A= ml di permanganato di potassio consumati nella titolazione
 N=concentrazione normale della soluzione di permanganato di potassio
N=concentrazione normale della soluzione di permanganato di potassio50 = massa equivalente di carbonato di calcio
V1=ml di soluzione iniziale di ammonio ossalato
V2=ml di soluzione campione sottoposto a titolazione con permanganato di potassio
m=massa di terreno fine sottoposta ad analisi
La quantità in g/Kg di calcare attivo si calcola con:
g/Kg = (C%·1000)/100
Esempio di calcolo - Si supponga di voler determinare la quantità di Calcare attivo in un campione di 10g di terra fine trattata come descritto per l'analisi con gli stessi reagenti e ammettendo che il volume di Permanganato consumato durante la titolazione sia di 15ml per il bianco e di 9,72ml per la titolazione del campione.
C% = (15-9,72)·0,001·0,1·50·(250/20)·10 = 3,3% g/Kg = (3,3·1000)/100 =33g/Kg
Determinazione della Capacità di Scambio Cationico C.S.C.
Lo scambio cationico è il principale meccanismo con cui il terreno trattiene e rilascia a disposizione delle piante elementi come calcio,magnesio,potassio e l'azoto.La CSC è quindi indice della fertilità chimica del terreno.
Analisi chimica - Titolazione
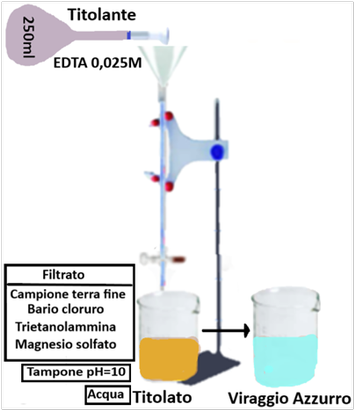
Reagenti:
- Soluzione di Bario cloruro/trietanolammina:in un becker da 1L sciogliere 100g di Bario cloruro diidrato in 800ml d’acqua distillata. Aggiungere 22,5ml di trietanolammina a aggiungere goccia a goccia Acido cloridrico 1M fino ad ottenere pH=8,0. Trasferire in matraccio da 1L e portare a volume con acqua distillata
- Soluzione di Magnesio solfato eptaidrato 0,05M
- Soluzione tampone a pH=10
- Indicatore Nero Ericromo T
- Soluzione di EDTA 0,025M
Porre 2g di terra fine (1g se molto argillosa) in una provetta da centrifuga, determinare il peso della provetta con il campione e annotarlo,aggiungere 25ml di soluzione di bario cloruro,tappare la provetta,agitare per tre minuti,lasciar riposare per 5 minuti ed agitare ancora per tre minuti. Centrifugare,raccogliere il surnatante e ripetere il trattamento per due volte unendo il surnatante a quello precedente.Lavare con 25ml di acqua, centrifugare,eliminare l’acqua e pesare la provetta. Aggiungere 25ml di soluzione di magnesio solfato, tappare la provetta,agitare e centrifugare.Trasferire 10ml di liquido in una beuta da 250ml e aggiungere 100ml di acqua distillata,10ml di tampone a pH=10 e una punta di spatola di indicatore.Titolare con la soluzione di EDTA fino a colore azzurro e parallelamente effettuare una prova in bianco titolando 10ml della soluzione di magnesio solfato . La C.S.C. si ricava con la formula:
C.S.C. = 0,5/m[25Vb-(Vt(25+B-A)]
 dove:
dove:C.S.C. = Capacità di Scambio Cationico in cmol/kg = meq/100g suolo
Vb=ml di soluzione di EDTA usati per titolare il bianco
Vt=ml di soluzione di EDTA usati per titolare il campione
A= massa della provetta e della terra contenuta
B= massa della provetta dopo centrifugazione
m= g di terra analizzati
Esempio di calcolo - Si supponga di voler determinare la CSC in un campione di 2g di terra fine trattata come descritto per l'analisi con gli stessi reagenti e ammettendo che il volume di EDTA durante la titolazione sia di 19,5ml per il bianco e di 15ml per la titolazione del campione e che la differenza di massa delle due pesate corrisponda a 1g .C.S.C. = 0,5/2·[25·19,5-(15(25+1)] = 24,4 cmol/kg
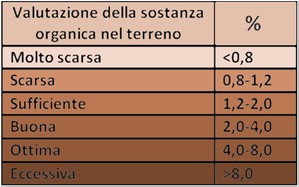
Determinazione del Carbonio organico
(Metodo di Walkley-Black)
La quantità di carbonio organico nel suolo è correlata con la presenza di humus che rende fertile il terrreno.
Analisi empirica - Test colorimetrico
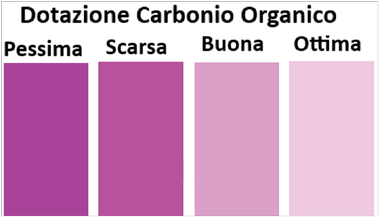 L'analisi si basa sullo scolorimento del terreno quando viene trattato con permanganato di potassio che ossida il carbonio.
L'analisi si basa sullo scolorimento del terreno quando viene trattato con permanganato di potassio che ossida il carbonio.In una provetta si trasfferiscono 5g di terra dopo averla ben essiccata,25ml di soluzione 0,33M di permanganato di potassio e 1ml di cloruro di calcio 0,1M. Si tappa la provetta, si agita per due minuti e si lascia riposare per 5 minuti al buio. Si diluiscono poi 5ml di soluzione con 45ml di acqua distillata in un'altra provetta. Si mescola e si valuta il colore della soluzione con quella di una carta colorimetrica.
Analisi chimica - Titolazione
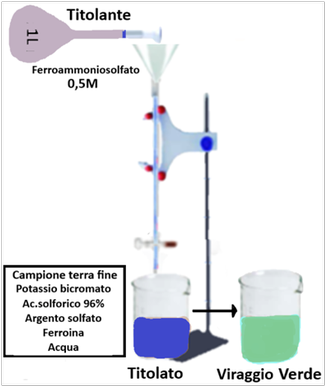 Reagenti:
Reagenti:- Soluzione di Bicromato di potassio 0,1667M
- Soluzione di Ferro solfato eptaidrato 0,5M (da verificare con titolazione in bianco).
- Acido solforico 96%
- Argento solfato
- Indicatore ferroina
Setacciare la terra fine a 2mm e trasferirne 1-2g in un matraccio da 250ml. Aggiungere 10ml di soluzione di Bicromato di potassio.Aggiungere lentamente 20 ml di Acido solforico 96% e pochi cristalli di Argento solfato agitando sempre lentamente. Coprire e lasciar riposare 30 minuti. Aggiungere poi 200ml di acqua distillata fredda da frigorifero. Addizionare 0,5ml di indicatore ferroina.Titolare con soluzione di ferro solfato eptaidrato fino a viraggio di colore dal blu al verde. Parallelamente effettuare una titolazione in bianco. Poichè il ferro solfato non è stabile,la sua concentrazione effettiva deve essere ricavata tramite titolazione in cui questa volta si utilizza il Bicromato di potassio come titolante.
Mf=(Vb·Mb·6)/Vf dove:
Mf = concentrazione molare effettiva del ferrosolfato eptaidrato da calcolare
Vb=ml di bicromato potassico consumato nella titolazione
Mb= concentrazione molare del bicromato potassico
Vf=ml di ferrosolfato eptaidrato titolati
Calcolare la quantità di Carbonio organico tramite la formula:
C(g/kg) = 3·(B-A)·Mf·m·1,3
dove:
C= g/kg di Carbonio organico
B=ml della soluzione di ferrosolfato eptaidrato utilizzato per la prova in bianco
A=ml della soluzione di ferrosolfato eptaidrato utilizzato per la titolazione del campione
Mf=concentrazione molare effettiva del ferrosolfato eptaidrato
m= g di terra analizzati
Per trasformare il Carbonio in Sostanza organica si utilizza la formula:1,724·C
Esempio di calcolo - Si supponga di voler determinare la quantità di Carbonio organico in un campione di 1g di terra fine trattata come descritto per l'analisi con gli stessi reagenti e ammettendo che il volume di ferro solfato eptaidratodurante la titolazione sia di 15,3ml per il bianco e di 10ml per la titolazione del campione.Inoltre,la titolazione di 15ml di ferrosolfato eptaidrato ha richiesto 8ml di bicromato potassico 0,1667M per la titolazione.La concentrazione effettiva del ferrosolfato eptaidrato è quindi:
Mf=(8·0,1667·6)/15=0,53M
C(g/Kg) = 3·(15,3-10,0)·0,53·1·1,3=11g/Kg %C=11·100/1000=1,1%
Sostanza organica=1,1·1,724=1,9%
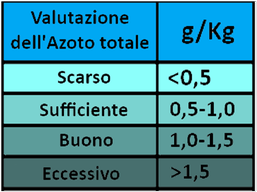
Determinazione dell'Azoto minerale
La concentrazione di azoto prontamente assimilabile dalle piante si definisce azoto minerale,costituito da nitrati,nitriti e ioni ammonio.L'azoto nitrico è quello maggiormente disponibile per le piante,quello ammoniacale più lentamente.
Analisi empirica - Test colorimetrico
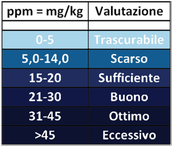
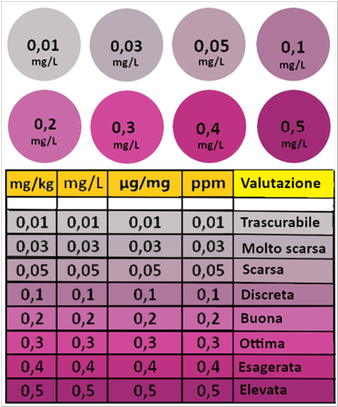 Il contenuto di nitrati nel terreno si può ottenere direttamente tramite l’acquisto di strisce colorimetriche o apparecchi digitali. Si setacciano piccoli campioni di terra dal campo a 2mm e si introducono in un contenitore 30g di terra setacciata con 30 g di acqua distillata.Si agita per molte volte la miscela e si decanta per 2 minuti. Immergere una striscia colorimetrica nel surnatante,scolare l’acqua in eccesso e attendere lo sviluppo di colore da confrontare con la scala colorimetrica in dotazione con le striscette. La quantità di nitrati in μg/g o ppm si calcola in questo modo:
Il contenuto di nitrati nel terreno si può ottenere direttamente tramite l’acquisto di strisce colorimetriche o apparecchi digitali. Si setacciano piccoli campioni di terra dal campo a 2mm e si introducono in un contenitore 30g di terra setacciata con 30 g di acqua distillata.Si agita per molte volte la miscela e si decanta per 2 minuti. Immergere una striscia colorimetrica nel surnatante,scolare l’acqua in eccesso e attendere lo sviluppo di colore da confrontare con la scala colorimetrica in dotazione con le striscette. La quantità di nitrati in μg/g o ppm si calcola in questo modo:ppm NO3‾ = lettura striscetta · 0,23 · (ml di acqua distillata + umidità % del suolo · g di terreno del campo)/g terreno secco
Il limite del metodo,anche se del tutto applicabile,risenta della valutazione visiva soggettiva poichè non sempre è facile valutare i colori. Il problema si risolve utilizzando apparecchi digitali. Un altro aspetto riguarda le unità di misura che in genere per i nitrati è espressa in mg/kg ma sui kit portatili è spesso espressa in mg/L o in μg/mg o in ppm. Non rappesentano un problema poichè sono equivalenti.
Analisi chimica - Distillazione e Titolazione
Azoto ammoniacale
Reagenti:
- Soluzione di Potassio cloruro 2M
- Fenolftaleina etanolica
- Acido borico 30g/L
- Ossido di magnesio
- Acido solforico 0,005M
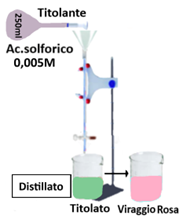
In un becker da 100ml trasferire 10g di terra fine (non essiccata)e aggiungere 100ml di Potassio cloruro 2M. Agitare per un’ora e filtrare in un matraccio.Nel frattempo far seccare in stufa a 40°C altri 10g di terra e calcolare per differenza di peso la quantità di acqua contenuta (f).Prelevare 50ml di surnatante e versarlo in un pallone da 1L con 2-3 pezzetti di pomice e qualche goccia di Fenolftaleina. Collegare il pallone all’apparecchio di Kjeldhal e aggiungere 10ml di Acido borico e 10ml di acqua distillata nella beuta da 500ml.Trasferire 3g di Ossido di magnesio MgO e 50ml di di acqua distillata nell’imbuto. Aprire il rubinetto e lascia defluire nel pallone.La sospensione deve apparire di colore rosa.Si chiude il rubinetto e si riempie per metà l’imbuto con acqua distillata.Distillare l’ammoniaca portando a ebollizione la soluzione nel pallone.Verificare immergendo una cartina indicatrice nella beuta di raccolta il termine della distillazione (cartina neutra),far bollire per altri 1-2 minuti,staccare il refrigerante e titolare il distillato con una soluzione di Acido solforico parallelamente a una titolazione in bianco.
Esempio di calcolo - Si supponga di voler determinare la quantità di Azoto ammoniacale in un campione di 10g di terra fine trattata come descritto per l'analisi con gli stessi reagenti e ammettendo che il volume di Acido solforico durante la titolazione del distillato sia di 18,5ml per il bianco e di 20ml per la soluzione di distillato.
C=(A-B)·0,005·28·D·f/m
N(g)=(17·N)·V·Fc/1000
N(g)=(17·0,1·20)·(18,5/20)/1000=0,031g
%C=0,031·100/10=0,31% C(g/Kg)=0,031·1000/10=3,1g/Kg
Azoto nitroso e nitrico
Aggiungere 2g di Lega di Devarda al residuo della distillazione nel pallone.Immergere il refrigerante in 10 ml di soluzione di Acido borico già presenti nella beuta e lasciar reagire per 20 minuti. Distillare e titolare come descritto in precedenza parallelamente a una titolazione in bianco.
La quantità di azoto minerale in mg/kg si ottiene con la formula: C=(A-B)·0,005·28·D·f/m
Dove C= quantità di azoto in mg/kg
A= ml di soluzione di acido solforico consumati nella titolazione
B= ml di soluzione di acido solforico consumati nella titolazione in bianco
D=fattore di diluizione = 250ml/50ml = 5
F= fattore di moltiplicazione per riferire i dati al campione di terra secca a 105°C
m=g del campione di terra usata per l’analisi
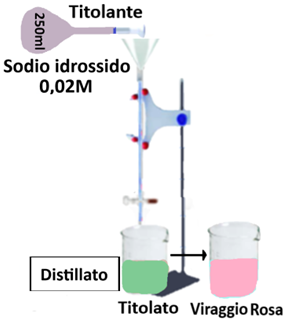
Determinazione dell'Azoto totale
Reagenti:
- Soluzione di Acido solforico 96%
- Soluzione di Acido solforico 0,01M (0,02N)
- Soluzione di Perossido d’idrogeno 30%
- Soluzione di Sodio idrossido 0,02M (0,02N)
- Soluzione di Sodio idrossido 300g/L
In un pallone da 300ml trasferire 2,5g di terra fine e aggiungere 11ml di Acido solforico 96% e alcune palline di vetro antispruzzo.Cautamente addizionare 4ml di Perossido d’idrogeno al 30%. Inserire un imbuti alla imboccatura del pallone e lasciar bollire per 30 minuti. Raffreddare, aggiungere lentamente altri 4ml di perossido d’idrogeno al 30% e bollire per altri 30 minuti. Raffreddare e trasferire la sospensione in un matraccio da 250ml portando a volume con acqua. Prelevare 200ml di surnatante e versarlo in un pallone da 500ml con 2-3 pezzetti di pomice. Collegare il pallone all’apparecchio di Kjeldhal.In una beuta da 500ml trasferire 50ml di soluzione di Acido solforico 0,01M e collegare il refrigerante.Aprire il rubinetto dell’imbuto, lasciare defluire nel pallone 30ml di soluzione di Sodio idrossido a 300g/L e lavare l’imbuto con acqua distillata.Si chiude il rubinetto e si riempie per metà l’imbuto con acqua distillata.Distillare l’ammoniaca portando a ebollizione la soluzione nel pallone.Verificare immergendo una cartina indicatrice nella beuta di raccolta il termine della distillazione (cartina neutra),far bollire per altri 1-2 minuti,staccare il refrigerante e titolare la soluzione di acido solforico nella beuta con la soluzione di sodio
 idrossido 0,02N (da verificare con una titolazione in bianco)e qualche goccia di indicatore.
idrossido 0,02N (da verificare con una titolazione in bianco)e qualche goccia di indicatore.La quantità di azoto minerale in g si ottiene con la formula:
N(g)=(49,02·N)·V·Fc/1000
Dove N(g)= quantità di azoto totale in g
N=concentrazione normale dell'acido solforico nella beuta
V= ml di soluzione di idrossido di sodio utilizzati nella titolazione
Fc = fattore di correzione della soluzione di idrossido di sodio (=ml bianco/ml nella titolazione)
m=g del campione di terra usata per l’analisi
Esempio di calcolo - Si supponga di voler determinare la quantità di Azoto totale in un campione di 2,5g di terra fine trattata come descritto per l'analisi con gli stessi reagenti e ammettendo che il volume di Sodio idrossido durante la titolazione di acido solforico sia di 3,8ml per il bianco e di 4ml per la soluzione di acido solforico nella beuta.
N(g)=(49,02·0,02)·4·(3,8/4)/1000=0,0037g
%C=0,0037·100/2,5=0,15% C(g/Kg)=0,0037·1000/2,5=1,5g/Kg
Rapporto C/N - E’ il rapporto carbonio organico/azoto totale ed è un buon parametro per definire la fertilità di un terreno.Si considera ottimale un valore C/N uguale a 10.
Se il valore è inferiore a 10 nel terreno vi è impoverimento della sostanza organica e liberazione di azoto. Se il valore è superiore a 10 vi è un impoverimento sia di azoto sia di sostanza organica.
Determinazione del Fosforo assimilabile
Per fosforo assimilabile si intende la quantità di fosforo presente nel terreno in soluzione e facilmente disponibile per le piante.
Analisi empirica - Test colorimetrico

 Il contenuto di fosfati nel terreno si può ottenere direttamente tramite l’acquisto di strisce colorimetriche o apparecchi digitali. Si setacciano piccoli campioni di terra dal campo a 2mm e si introducono in un contenitore 30g di terra setacciata con 30 g di acqua distillata.Si agita per molte volte la miscela e si decanta per 2 minuti.Immergere una striscia colorimetrica nel surnatante,scolare l’acqua in eccesso e attendere lo sviluppo di colore da confrontare con la scala colorimetrica in dotazione con le striscette.
Il contenuto di fosfati nel terreno si può ottenere direttamente tramite l’acquisto di strisce colorimetriche o apparecchi digitali. Si setacciano piccoli campioni di terra dal campo a 2mm e si introducono in un contenitore 30g di terra setacciata con 30 g di acqua distillata.Si agita per molte volte la miscela e si decanta per 2 minuti.Immergere una striscia colorimetrica nel surnatante,scolare l’acqua in eccesso e attendere lo sviluppo di colore da confrontare con la scala colorimetrica in dotazione con le striscette.Analisi chimica - Spettrofotometria UV-VIS/Colorimetria (metodo Olsen)
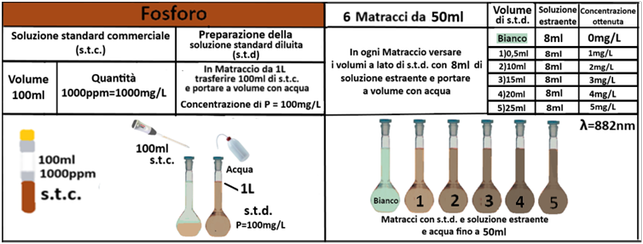
Reagenti:
- Carbone attivo
- Soluzione di Antimonio potassio tartrato 1mg/ml
- Reagente solfomolibdico - miscelare 50ml di Acido solforico 2,5M con 15ml di Ammonio molibdato 40g/L, 30ml di Acido ascorbico 0,1M e 5ml di Antimonio potassio tartrato 1mg/m
In un matraccio da 125ml si trasferiscono 2g di terra fine, 0,5g di Carbone attivo e 40ml (V1)di soluzione di Bicarbonato di sodio a pH 8,5.Agitare per 30 minuti e filtrare più volte trasferendo il filtrato in un contenitore con tappo.Prelevare una aliquota della soluzione limpida V2 e trasferirla in un matraccio da 50ml.
Aggiungere 5 gocce di p-nitrofenolo e acido solforico goccia a goccia fino a colorazione gialla.Diluire a 25ml con acqua distillata, aggiungere 8ml del reagente solfomolibdico e portare a volume con acqua. Dopo 10 minuti leggere il valore di assorbanza a 882nm a uno spettrofotometro contro un bianco che contenga tutti i reagenti tranne la soluzione di fosforo.
Prelevare e trasferire in sei matracci da 50ml 0,5;10;15;20 e 25ml della soluzione standard diluita di fosforo. Diluire a 25ml con acqua e aggiungere 8ml di Solfo molibdato e portare a volume con acqua. In ognuna delle sei soluzioni,la concentrazione del fosforo è rispettivamente 0;1;2;3;4 e 5 mg/L.
Per calcolare il contenuto di fosforo in mg/Kg si utilizza la formula: C=(A-B)(V1/V2)(50/M)
Dove: c=mg/Kg di fosforo assimilabile nel terreno
A= concentrazione di fosforo nella soluzione del campione in mg/L
B= concentrazione di fosforo nella soluzione del bianco in mg/L
V1= volume dell’estratto (40ml)
V2= volume della soluzione del campione utilizzata per l’analisi colorimetrica
M= g del campione di terra
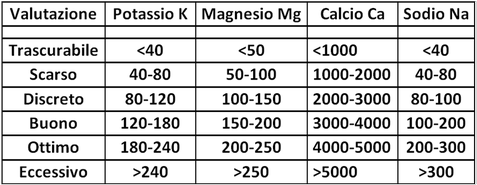
Determinazione delle Basi di Scambio (Potassio,Magnesio,Calcio e Sodio)
Analisi chimica - Spettrofotometria F-AAS (metodo con Bario cloruro)
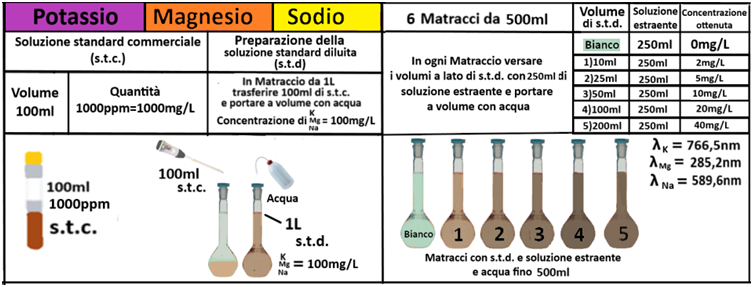
Reagenti:
- Trietanolammina
In un matraccio da 250ml si trasferiscono 2,5g di terra fine e 50ml di soluzione di Cloruro di bario e Trietanolammina a pH=8,1.Agitare per 1 ora e filtrare più volte trasferendo il filtrato in un contenitore di plastica con tappo. Prelevare 1ml della soluzione e trasferirla in un matraccio da 25ml con 2,5ml di soluzione di Lantanio. Portare a volume e mescolare. Eseguire allo stesso modo una prova in bianco.Costruire una retta di taratura con uno spettrofotometro utilizzando per potassio,magnesio e sodio 5 soluzioni
contenenti 2;5;10;20;40mg/L di ciascun
elemento e per il calcio 4 soluzioni che ne contengono2;5;10; 20mg/L.Dopo aver inserito la lampada corretta nello spettrofotometro, si seleziona la lunghezza d’onda per ciascun elemento.
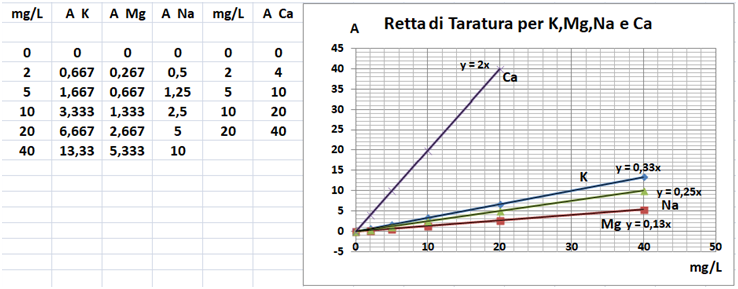
Azzerare lostrumento con una soluzione di cloruro di bario e trietanolammina a pH=8,1 per il potassio, magnesio e sodio e la soluzione in bianco per il calcio. Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione.Per calcolare il contenuto di ciascuna base di scambio si utilizza la formula:
C=(A-B)·D·10/m·E
Dove : C= centimoli/kg (= )di ciascun elemento
A= mg/L dell’elemento nella soluzione del campione
B= mg/L dell’elemento nella soluzione in bianco
D= fattore di diluizione (10 per Ca e Mg;5 per K e Na)
m=g del campione di terra
E = 20,04 per Ca;12,16 per Mg;39,1 per K;22,99 per Na)
Per esprimere i risultati in mg/kg moltiplicare il valore in cmol/kg di Ca,Mg,K e Na rispettivamente per 200;121 per Mg;391 per K e 230 per Na.
Per esprimere i risultati in K2O,MgO e CaO moltiplicare i valori in mg/kg di K,Mg e Ca per 1,2046;1,658 e 1,399.
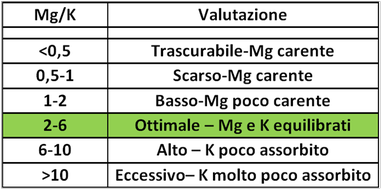
Rapporto Mg/K - Rapporto tra la quantità di magnesio scambiabile (Mg) e la quantità di potassio scambiabile (K).Nella valutazione dell' assorbimento del magnesio non è sufficiente considerare solo la sua carenza in termini assoluti, ma anche il suo assorbimento in funzione dei livelli di potassio.
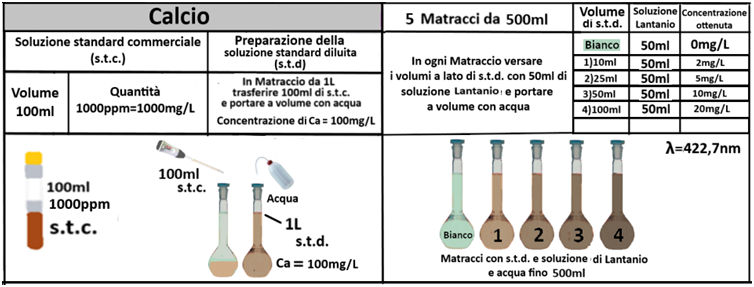
Determinazione del fabbisogno in Gesso
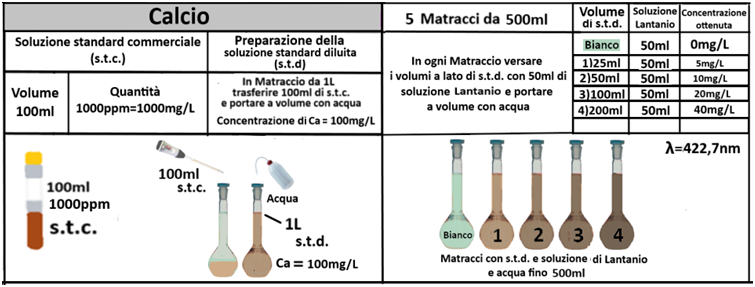
Spettrofotometria F-AAS
Reagenti:
- Soluzione satura di Solfato di calcio diidrato
- Soluzione di Lantanio nitrato 20g/L
In una beuta da 200ml si trasferiscono 5g di terra fine e 100ml di soluzione satura di Solfato di calcio.Tappare la beuta, agitare meccanicamente per 30 minuti e filtrare trasferendo il filtrato in un contenitore di plastica con tappo. Prelevare 1ml della soluzione e trasferirla in un matraccio da 25ml con 2,5ml di soluzione di Lantanio. Portare a volume con 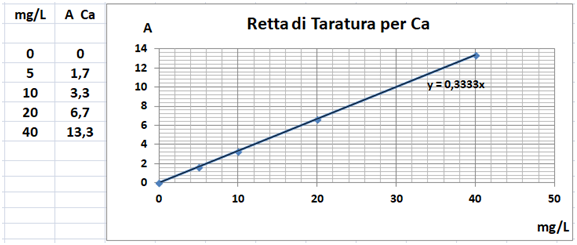 acqua,tappare e mescolare. Costruire una retta di taratura con uno spettrofotometro utilizzando 5 soluzioni di riferimento contenenti 5;10;20;40mg/L di calcio.Dopo aver inserito la lampada corretta per il calcio nello spettrofotometro, si seleziona la lunghezza d’onda di 422,7nm.Si azzera lo strumento con la soluzione del bianco di lantanio e si leggono i valori delle assorbanze delle soluzioni di riferimento.Dalla retta di taratura si ricava l’assorbanza del campione. Il fabbisogno in gesso si ricava con la formula:
acqua,tappare e mescolare. Costruire una retta di taratura con uno spettrofotometro utilizzando 5 soluzioni di riferimento contenenti 5;10;20;40mg/L di calcio.Dopo aver inserito la lampada corretta per il calcio nello spettrofotometro, si seleziona la lunghezza d’onda di 422,7nm.Si azzera lo strumento con la soluzione del bianco di lantanio e si leggono i valori delle assorbanze delle soluzioni di riferimento.Dalla retta di taratura si ricava l’assorbanza del campione. Il fabbisogno in gesso si ricava con la formula:
 acqua,tappare e mescolare. Costruire una retta di taratura con uno spettrofotometro utilizzando 5 soluzioni di riferimento contenenti 5;10;20;40mg/L di calcio.Dopo aver inserito la lampada corretta per il calcio nello spettrofotometro, si seleziona la lunghezza d’onda di 422,7nm.Si azzera lo strumento con la soluzione del bianco di lantanio e si leggono i valori delle assorbanze delle soluzioni di riferimento.Dalla retta di taratura si ricava l’assorbanza del campione. Il fabbisogno in gesso si ricava con la formula:
acqua,tappare e mescolare. Costruire una retta di taratura con uno spettrofotometro utilizzando 5 soluzioni di riferimento contenenti 5;10;20;40mg/L di calcio.Dopo aver inserito la lampada corretta per il calcio nello spettrofotometro, si seleziona la lunghezza d’onda di 422,7nm.Si azzera lo strumento con la soluzione del bianco di lantanio e si leggono i valori delle assorbanze delle soluzioni di riferimento.Dalla retta di taratura si ricava l’assorbanza del campione. Il fabbisogno in gesso si ricava con la formula:C= (A-B)D/20,04P dove:
C = Fabbisogno in gesso in cmol/kg
A= mg/L di calcio nella soluzione di solfato di calcio
B= mg/L di calcio nella soluzione del campione derivati dalla retta di taratura
D = fattore di diluizione
P= g di terra analizzati
20,04 = peso equivalente del calcio
Determinazione dei microelementi Ferro,Manganese,Zinco e Rame
Analisi chimica - Spettrofotometria F-AAS (metodo Lindsay-Norwell per terreni con pH>6,5)
 Reagenti:
Reagenti:- Trietanolammina
In un matraccio da 250ml si trasferiscono 50g di terra fine e 100ml di soluzione di DTPA. Agitare per 2 ore e filtrare più volte in matraccio da 1L e portare a volume con acqua distillata trasferendo il filtrato in un contenitore di plastica con tappo. Costruire una retta di taratura con uno spettrofotometro utilizzando per ferro,manganese,7 soluzioni contenenti 0;2;5;10;15;20;25ml di ciascun elemento e per lo zinco e rame 0;0,5;1;2;5;10;15ml di ciascun elemento.Dopo aver inserito la lampada corretta nello spettrofotometro, si seleziona la lunghezza d’onda che per ciascun elemento è: Azzerare lo strumento con una soluzione di DTPA. Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione. La concentrazione di ciascun elemento è data da:
C=(A·V) ·1000/m
Dove : C= mg/kg di ciascun elemento
A= mg/L dell’elemento ricavata dalla retta di taratura
V= L di soluzione estraente
m=g del campione di terra
Metodo Lakanen-Ervio per terreni con pH<6,5
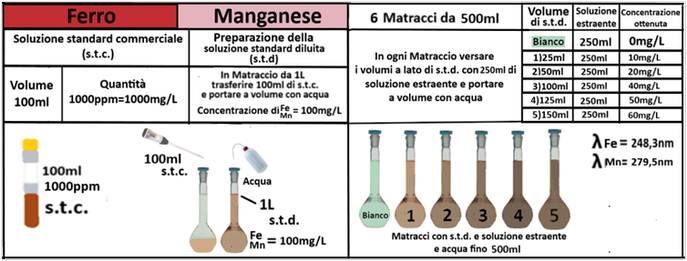
Reagenti:
- Soluzione di Ammonio acetato 0,5M
- Acido acetico glaciale e 1:10
- Soluzione di EDTA 0,02M
- Soluzione di Ammonio idrossido 1:10
- Soluzione estraente - In un becker da 1L sciogliere 38,5g di Ammonio acetato in 500ml di acqua distillata e
addizionare 25ml di Acido acetico glaciale e 5,845g di EDTA. Portare il pH della soluzione a 4,6-4,7 aggiungendo Ammonio idrossido o Acido acetico. Trasferire in matraccio da 1L e portare a volume con acqua distillata.
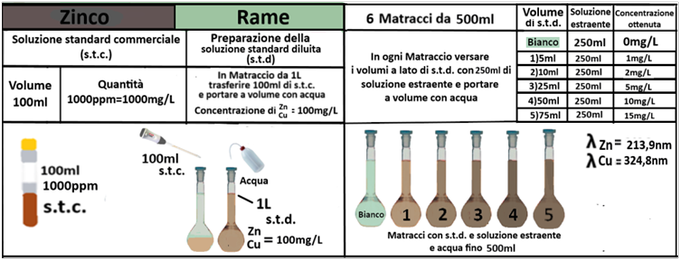
Per ferro e manganese prelevare 200ml di soluzione standard e portare a volume di 1L con acqua distillata in matraccio. Si ottiene una concentrazione di ferro e manganese di 200mg/L. Per zinco e rame prelevare 100ml di soluzione standard e portare a volume di 1L con acqua distillata in matraccio. Si ottiene una concentrazione di ferro e manganese di 100mg/L.
In un matraccio da 250ml sitrasferiscono 20g di terra fine e 100ml di soluzione di EDTA.Agitare per 30 minuti e filtrare più volte trasferendo il filtrato in un contenitore di plastica con tappo. Costruire una retta di taratura con uno spettrofotometro utilizzando per ferro,manganese, 6 soluzioni contenenti 0;10;20;40;50;60ml di ciascun elemento e per zinco e rame 0;1;2;5;10;15ml di ciascun elemento.Dopo aver inserito la lampada corretta nello spettrofotometro, si seleziona la lunghezza d’onda per ciascun elemento.
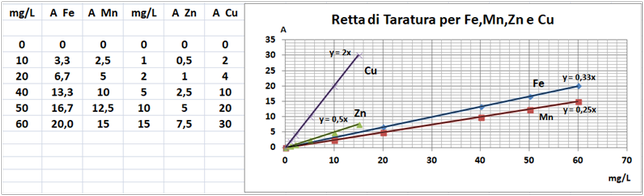 Azzerare lo strumento con una soluzione di EDTA.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione.
Azzerare lo strumento con una soluzione di EDTA.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione.La concentrazione di ciascun elemento è data da:C=(A·V) ·1000/m
Dove : C= mg/kg di ciascun elemento
A= mg/L dell’elemento ricavata dalla retta di taratura
V= L di soluzione estraente
m=g del campione di terra
Determinazione del Ferro estraibile
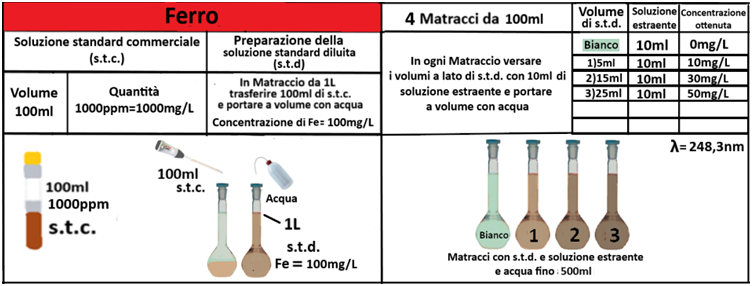
Spettrofotometria F-AAS
Reagenti:
- Soluzione di Ammonio ossalato 0,2M
- Soluzione di Potassio cloruro 10g/L
- Soluzione estraente - Superfloc
In un contenitore di plastica per centrifugazione da 100ml si trasferisce 1g di terra fine,50ml di soluzione di Ammonio ossalato a pH=3. Tenere in agitazione al buio per 4 ore. Trasferire 25ml di soluzione in provetta da centrifuga da 50mlcon 3 gocce di Superfloc. Agitare e centrifugare per 15 minuti a 2500giri/min. Trasferire 10ml di surnatante in un matraccio da 50ml e portare
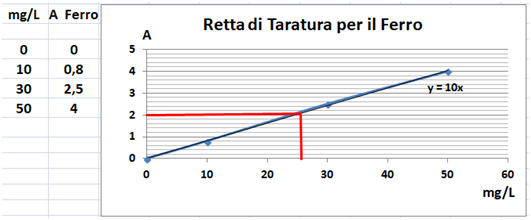 a volume con una soluzione di Potassio cloruro per diluire 5 volte. Trasferire 10ml di surnatante in un matraccio da 200ml e portare a volume con una soluzione di Potassio cloruro per diluire 20 volte. Eseguire allo stesso modo una prova in bianco.Costruire una retta di taratura con uno spettrofotometro utilizzando 4 soluzioni di riferimento contenenti 0;5;15;25 mg/L di ferro.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione a 248,3nm.
a volume con una soluzione di Potassio cloruro per diluire 5 volte. Trasferire 10ml di surnatante in un matraccio da 200ml e portare a volume con una soluzione di Potassio cloruro per diluire 20 volte. Eseguire allo stesso modo una prova in bianco.Costruire una retta di taratura con uno spettrofotometro utilizzando 4 soluzioni di riferimento contenenti 0;5;15;25 mg/L di ferro.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione a 248,3nm.La concentrazione di Ferro estraibile è data da:C=(A-B)·D·V/m
Dove : C= mg/kg di Ferro estraibile
A= mg/L di Ferro estraibile nella soluzione del campione derivati dalla retta di taratura
B= mg/L di Ferro estraibile nella soluzione in bianco
D = fattore di diluizione (5 o 20)
m= g di terra analizzati
Indice di Potere Clorosante - In relazione ad una eccessiva concentrazione di calcare si manifesta una carenza di ferro nota come clorosi ferrica che causa ingiallimento delle foglie delle piante e crescita stentata. Un fattore per determinare l’incidenza di clorosi ferrica è fornito dall’indice di potere clorosante che se assume valori superiori a 100 significa che è molto probabile l'insorgenza di clorosi.
I.P.C. = %CaCO3 · 10000 / (Fe)2
Dove: %CaCO3=percentuale di calcare attivo
Fe=mg/kg(=ppm)di ferro estraibile
Per es. se la % di Calcare attivo è del 2% e la concentrazione di Ferro estraibile è di 25ppm si ha:
I.P.C. = 2 · 10000 / (25)2 = 50
Se il Calcare attivo è espresso in g/kg (per es. 4g/kg) e la concentrazione di Ferro estraibile è di 5ppm si ha:
I.P.C. = 4 · 1000 / (5)2 = 160
Determinazione del Boro solubile
Spettrofotometria UV-VIS/Colorimetria
Reagenti:
- Ammonio acetato
- Potassio acetato
- Soluzione tampone
- Sale disodico dell’acido nitrilotriacetico monoidrato al 99%
- EDTA
- Soluzione di Acido acetico 100ml/L
- Azometina H
- Acido ascorbico
- Soluzione di Magnesio cloruro 2g/L
- Carbone attivo
- Soluzione tampone – in matraccio da 1L sciogliere 280g di Ammonio acetato,20g di Potassio acetato,4g di Sale disodico dell’acido nitrilotriacetico monoidrato al 99% e 20g di EDTA in 700ml di Acido acetico 100ml/L. Portare a volume di 1L con acqua distillata.
- Reagente colorimetrico – in un becker di plastica trasferire 1g di Azometina H,2,2g di Acido ascorbico e 50ml di acqua distillata. Trasferire in matraccio da 250ml e portare a volume con la soluzione tampone. La soluzione è stabile per pochi giorni.
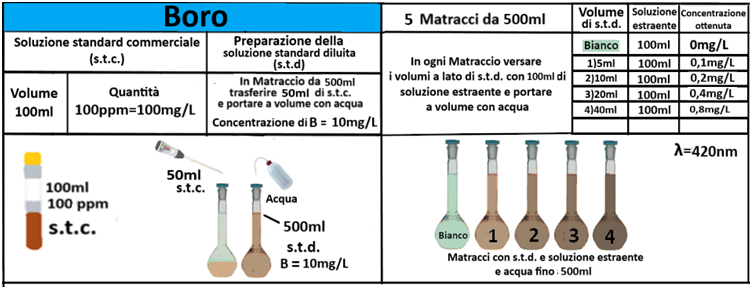
In una beuta da 250ml si trasferiscono 50g di terra fine,100ml di soluzione di Magnesio cloruro e 2-3g di Carbone attivo. Tappare la beuta con un refrigerante e scaldare ad ebollizione per 5 minuti. Raffreddare e filtrare più volte trasferendo il filtrato in un contenitore di plastica con tappo. Eseguire allo stesso modo una
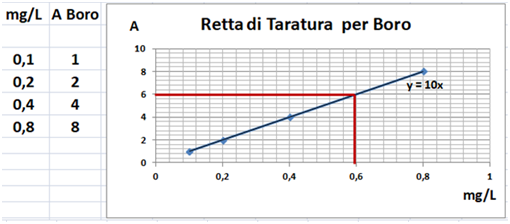
prova in bianco.Trasferire 10ml di filtrato in un becker di plastica da 25ml contenente 5ml di Azometina H e agitare per un’ora. Leggere l’assorbanza della soluzione colorata a 420nm in cuvetta da 20mm in spettrofotometro contro la prova in bianco. Costruire una retta di taratura con uno spettrofotometro utilizzando 4 soluzioni di riferimento da 10ml contenenti 0,1;0,2;0,4;0,8 mg/L di boro.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione. La concentrazione di Boro è data da:
C=(A·V) ·1000/m
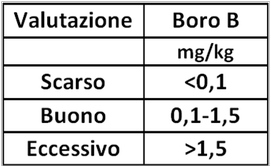
Dove : C= mg/kg di Boro
A= mg/L di Boro ricavata dalla retta di taratura
V= L di soluzione estraente
m=g del campione di terra
Determinazione dello Zolfo da Solfati
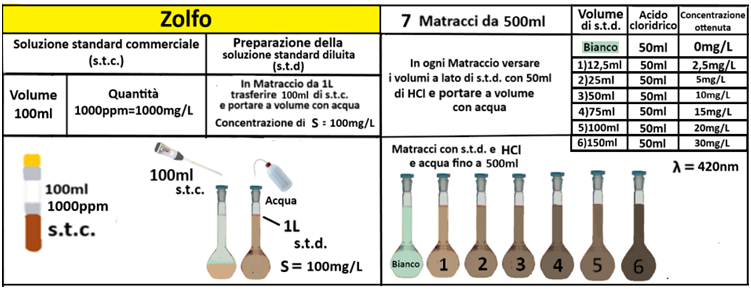
Analisi chimica - Spettrofotometria F-AAS e Turbidimetria
Reagenti:
- Soluzione di Acido cloridrico 37%
- Bario cloruro diidrato
In un becker da 250ml si trasferiscono 10g di terra fine,150ml di acqua distillata e 25 ml di Acido cloridrico al 37%. Terminata l’effervescenza,far bollire per 30 minuti su
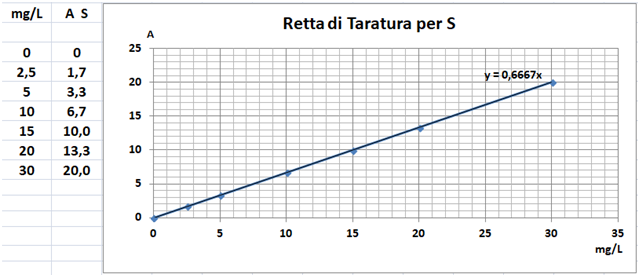
piastra. Trasferire in matraccio da 250ml,portare a volume con acqua distillata,tappare e filtrare trasferendo il filtrato in un contenitore di plastica con tappo. Trasferire 25ml di filtrato in un matraccio da 50ml, portare a volume e miscelare. Con una buretta trasferire 25ml delle soluzioni di riferimento in sette palloni da 50ml. Trasferire 25ml del filtrato nel matraccio in un altro matraccio da 50ml con 0,5g di Cloruro di bario. Lasciar riposare mescolando per 15 minuti e portare a volume con acqua distillata. Leggere l’assorbanza delle soluzioni di riferimento (0;2,5;5;10;15;20;30mg/L di S) a 420nm in cuvetta da 10mm in spettrofotometro contro la prova in bianco. Costruire una retta di taratura leggendo i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione. La concentrazione di Zolfo è data da:
C=(A·D·V) ·1000/m
Dove : C= mg/kg di Zolfo
A= mg/L di Zolfo ricavata dalla retta di taratura
V= L di soluzione estraente (025)
m=g del campione di terra
La concentrazione di solfati è data da: C·2,996
Determinazione dell'Indice di Disponibilità del Cobalto
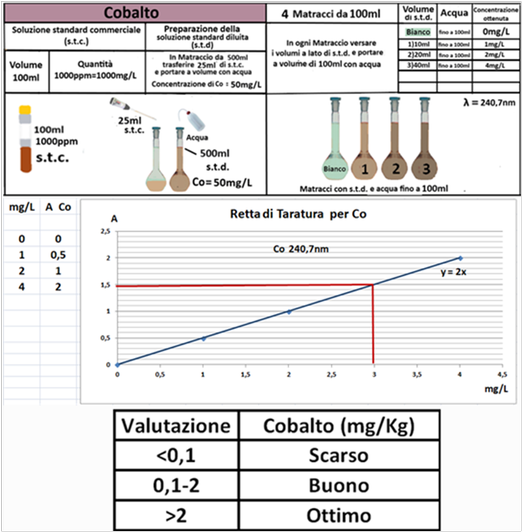 Spettrofotometria F-AAS
Spettrofotometria F-AASReagenti:
- Soluzione di Acido acetico 2,5%
- Acido cloridrico 1M
- Perossido d’idrogeno 33%
In un matraccio da 500ml si trasferiscono 10g di terra fine e 200ml di soluzione di Acido acetico al 2,5%.Tenere in
agitazione per 8 ore a 100cicli/min e trasferire poi in una provetta da centrifuga e centrifugare per 10 minuti a 5000giri/min. Versare il surnatante in un becker da 500ml lavando il residuo con la soluzione di acido acetico,centrifugando etrasferendo sempre il surnatante nello stesso becker. Portare a secco su piastra
elettrica,aggiungere 5ml di Perossido d’idrogeno e portare nuovamente a secco.Aggiungere 10ml di Acido cloridrico 1M,riscaldare per 15 minuti su piastra e trasferire la soluzione in un matraccio da 20ml.Portare a volume con
acqua distillata ed eseguire la stessa operazione in bianco senza il campione. Costruire una retta di taratura utilizzando uno spettrofotometro con lampada per il cobalto e leggendo i valori delle assorbanze a 240,7nm delle soluzioni di riferimento (0;1;2;4mg/L di Co)e di quella del bianco e risalire alla quantità di cobalto misurando l’assorbanza del campione.La concentrazione di Cobalto è data da:
C=(A-B)D·V/m
Dove : C= mg/kg di Cobalto
A= mg/L di Cobalto ricavata dalla retta di taratura
B= mg/L di Cobalto nella soluzione in bianco
D = fattore di diluizione (=1 se non si è diluita la soluzione)
V= volume finale in ml
m=g del campione di terra
Determinazione dell'Indice di Disponibilità del Molibdeno
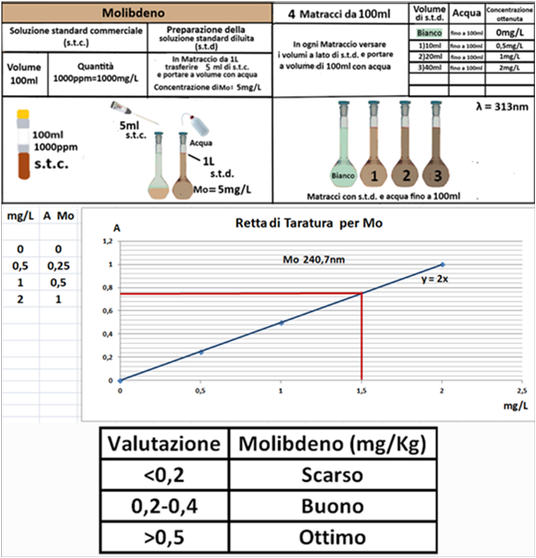 Spettrofotometria F-AAS
Spettrofotometria F-AASReagenti:
- Bicarbonato d’ammonio
- DTPA
- Idrossido d’ammonio
- Acido nitrico 65%
- Soluzione Bicarbonato d’ammonio-DTPA-Idrossido d’ammonio - In un becker da 1L con 800 ml di acqua distillata,versare 1,97g di DTPA e 2ml di Ammonio idrossido 1:1. Mescolare per 15 minuti e aggiungere 79,06g di Ammonio bicarbonato. Portare il pH a 7,6 con Acido cloridrico o Ammonio idrossido. Trasferire in matraccio da 1L e portare a volume con acqua distillata.
In un matraccio da 250ml si trasferiscono 10g di terra fine e 20ml di soluzione di Bicarbonato d’ammonio-DTPA-Idrossido d’ammonio.Tenere in agitazione per 15 minuti a 100cicli/min e trasferire poi in una provetta da centrifuga e centrifugare per 5 minuti a 5000giri/min Versare 2,5 ml di surnatante in un matraccio da 50ml contenente 0,25ml di Acido nitrico al 65%.Portare a volume con acqua distillata ed eseguire la stessa operazione in bianco senza il campione. Costruire una retta di taratura utilizzando uno spettrofotometro con lampada per il molibdeno e leggendo i valori delle assorbanze a 313nm delle soluzioni di riferimento (0;0,5;1;2mg/L di Co)e di quella del bianco e risalire alla quantità di molibdeno misurando l’assorbanza del campione.La concentrazione di Molibdeno è data da:
C=(A-B)D·V/m
Dove : C= mg/kg di Molibdeno
A= mg/L di Molibdeno ricavata
dalla retta di taratura
B= mg/L di Molibdeno nella soluzione in bianco
D = fattore di diluizione (=1 se non si è diluita la soluzione)
V= volume finale in ml
m=g del campione di terra
Determinazione dei Metalli pesanti inquinanti (Cadmio,Cromo,Nichel,Piombo)
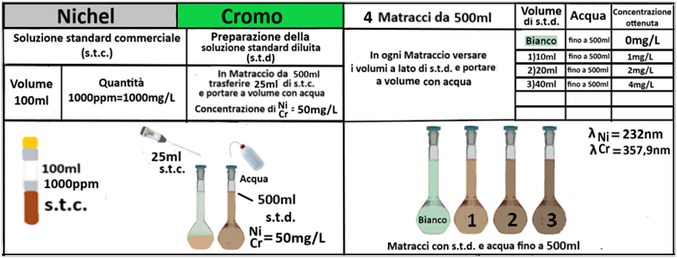
Spettrofotometria F-AAS
Reagenti:
- Soluzione di Acido nitrico 65%
Soluzione di
Acido cloridrico 37%
In un becker da 50ml si trasferiscono 1g di terra fine e 3ml di Perossido d’idrogeno. Lasciar riposare per 20 minuti,aggiungere 9ml di Acido
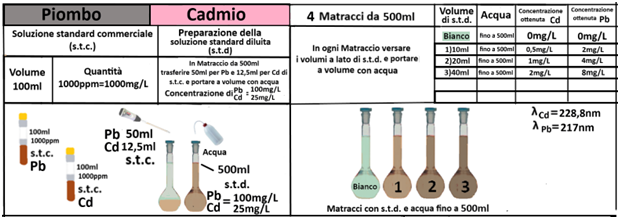
cloridrico e 3ml di Acido nitrico.Chiudere il matraccio e inserire in forno a microonde con il seguente ciclo: 10 minuti a 250W;10 minuti a 450W;10 minuti a 600W;5 minuti a 250W;10 minuti di ventilazione. Lasciar raffreddare, trasferire in provetta da centrifuga e centrifugare a 4000 giri/min per 5 minuti. Trasferire il surnatante in un matraccio da
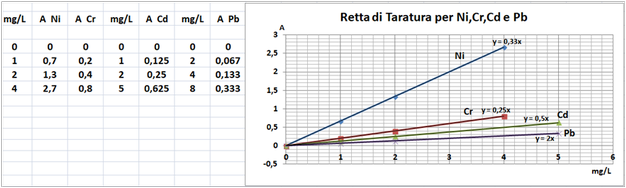
100ml,lavare con acqua il residuo, centrifugando e aggiungendo il surnatante nello stesso matraccio. Portare a volume con acqua distillata ed effettuare una prova in bianco sulla soluzione di perossido d’idrogeno , Acido cloridrico e Acido nitrico. Costruire una retta di taratura con uno spettrofotometro utilizzando per cadmio,cromo,nichel e piombo 4 soluzioni contenenti 0;0,5;1;2 mg/L di cadmio;0;1;2;4 mg/L di cromo e nichel; 0;2;4;8 mg/L di piombo. Dopo aver inserito la lampada corretta nello spettrofotometro,si seleziona la lunghezza d’onda che per ciascun elemento è: 228,8nm per Cd,357,9nm per Cr,232nm per Ni e 217 per Pb.Leggere i valori delle assorbanze delle soluzioni di riferimento e di quella del bianco e costruire la retta di taratura misurando l’assorbanza del campione.
C = (A-B)DV/m
Dove:
C=mg/kg di metallo pesante
A=concentrazione del metallo nella soluzione campione in mg/L
B=concentrazione del metallo nella soluzione in bianco in mg/L
