L'Analisi dell'Acqua
MENU
ANALISI DELL'ACQUA IRRIGUA
L'acqua utilizzata per l'irrigazione non possiede solo il compito di soddisfare le esigenze idriche delle colture ma,non essendo acqua distillata,contiene anche sali minerali disciolti in essa. Questo comporta alcune considerazioni:
- i sali minerali disciolti sono a tutti gli effetti dei nutrienti e per quanto in generale la loro quantità nell'acqua sia trascurabile per quanto riguarda la coltivazione convenzionale,ciò non è altrettanto vero per particolari tecniche colturali come la fertirrigazione.
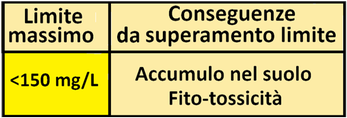
- i sali minerali disciolti,se presenti in eccesso,aumentano la salinità del suolo con conseguenze dannose.
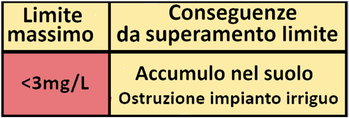
- Carbonati e bicarbonati,se in eccesso,alterano il pH del suolo basificandolo e danno origine al calcare che può incrostare ed ostruire l'impianto d'irrigazione.
-Cloruri,fluoruri e sodio,se presenti in eccesso,sono fito-tossici.
- I microelementi presenti nell'acqua sono importanti per le funzioni metaboliche delle colture ma,se in eccesso sono fito-tossici.
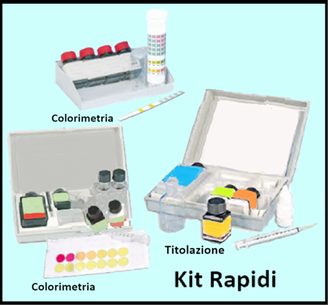
L'acqua può essere analizzata presso laboratori d'analisi ambientale,oppure consultando le metodiche chimiche ufficiali in seguito descritte.Tuttavia sono oggi disponibili molti kit che permettono di eseguire le analisi in modo molto semplice e anche sul campo.
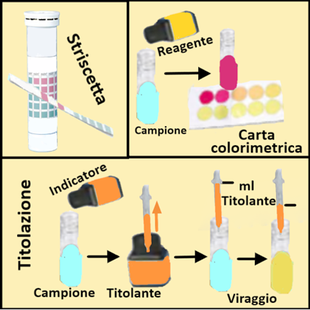
In particolare le misurazioni si effettuano immergendo una striscia nel campione d'acqua per poi risalire alla concentrazione di una determinata sostanza tramite confronto tra il colore assunto dalla striscetta e una carta colorimetrica in dotazione.In altri kit si aggiungono invece reattivi al campione d'acqua e si osserva il colore che si sviluppa.Con tali strumenti si possono in genere valutare le concentrazioni di Azoto ammoniacale,Nitrati,Nitriti,Potassio,Calcio,Cloro, Cloruri,Cobalto, Ferro,Fosforo,Manganese,Molibdeno,Rame,Solfati e Zinco.Alcuni kit permettono di eseguire misurazioni per titolazione riguardanti in genere la concentrazione di Calcio,Cloruri e Durezza dell'acqua.
Pur essendo molto pratici da utilizzare,hanno il difetto che sono soggetti alla capacità di coloro che compiono l'analisi di identificare adeguatamente le colorazioni.Inoltre vengono rilevate le concentrazioni dei vari elementi solo in determinati intervalli di valori,per esempio tra 0-10 e 15-50mg/L,non permettendo di conoscerne il valore esatto(per es. 7mg/L).
Come per il suolo,anche per l'acqua irrigua si possono eseguire analisi chimiche accurate per determinarne i parametri chimici e fisici. Anche in questo caso occorre però possedere conoscenze di chimica ed essere particolarmente prudenti nel manipolare le sostanze chimiche in molti casi alquanto pericolose.
L'attrezzatura necessaria per le analisi è del tutto analoga a quella per il suolo ad eccezione di alcune metodi detti potenziometrici.Le analisi spettroscopiche,come per i campioni di terra,vengono effettuate utilizzando spettrofotometri anche se i metodi ufficiali di analisi prevedono l'uso di specifici spettrometri detti ad assorbimento atomico di fiamma(AAS). Per le analisi che lo prevedono si descriveranno le metodiche con AAS dando per scontato che si possono utilizzare anche comuni spettrofotometri.
Un'altra differenza rispetto all'analisi del suolo consiste nel fatto che essendo il campione da analizzare un quantitativo d'acqua,per la sua filtrazione si utilizzano più propriamente membrane filtranti al posto della comune carta da filtro.
Solventi

Come per l'analisi del suolo,il solvente per definizione è l'acqua distillata.In questo caso però deve essere di ottima qualità altrimenti gli eventuali sali minerali residui disciolti interferirebbero con il campione che è costituito sempre da acqua.
Gli altri solventi utilizzati sono rappresentati da:
Alcool etilico 95%;Alcool isopropilico;Etere etilico e Cloroformio. I primi tre sono infiammabili. Il Cloroformio è notoriamente narcotico se inalato.
Acidi

Acido acetico glaciale
Acido cloridrico concentrato
Acido cloridrico diluito (1+1). Diluire l'acido cloridrico con un ugual volume di acqua.
Acido cloridrico 0,02 N. Aggiungere 1,7 mL di acido cloridrico concentrato a 100 mL di acqua distillata e diluire a 1L.
Acido cloridrico (1+99). Aggiungere un volume di HCl concentrato a 99 volumi di acqua.
Acido solforico - liquido da acquistare in concentrazione al 96%. Molto corrosivo e reagisce con l'acqua sviluppando calore. Da manipolare con molta prudenza.
Acido solforico 0,5 M. Aggiungere molto lentamente e sotto raffreddamento 28 mL di acido solforico a 500 mL di acqua. Dopo raffreddamento diluire a 1L con acqua
Soluzione di acido solforico (1+3): Aggiungere lentamente 25 mL di acido solforico concentrato[H2SO4] (d = 1,84) a 50 mL di acqua. Dopo raffreddamento, diluire a 100 mL con acqua.
Acido cloroplatinico
Acido ascorbico
Soluzione. Sciogliere 27 g di acido ascorbico in 500 mL di acqua.Conservare la soluzione in bottiglie di polietilene ed in frigorifero. In tal modo è stabile per molti mesi. Non si può mantenere la soluzione alla temperatura ambiente per più di due o tre giorni.
Acido borico anidro
Basi

Idrossido d’ammonio - liquido da acquistare in concentrazione al 30%. E' ammoniaca solubilizzata in acqua.Ha un fortissimo odore penetrante ed irritante
Idrossido di sodio
solido
Soluzione 0,1 M. Sciogliere in acqua 4 g di idrossido di sodio e diluire a 1L con acqua.Si trova anche in commercio già pronto.
Soluzione di idrossido di sodio 1 N. Sciogliere 40 g di NaOH e portare a 1L con acqua in
matraccio tarato.
Soluzione di idrossido di sodio 0,1 N. Introdurre 10 mL della soluzione di NaOH 1 N in matraccio
tarato da 100 mL e portare a volume con acqua.
Soluzione di idrossido di sodio 5 MSciogliere in 1 L di acqua circa 200 g di idrossido di sodio (NaOH).
Ipoclorito di sodio Soluzione 5% in cloro libero(m/v)-Si diluisce opportunamente con acqua una soluzione a titolo noto di ipoclorito di sodio [NaClO] concentrato. La soluzione si decompone lentamente e va conservata in bottiglia scura; il suo titolo va controllato spesso.
Soluzione di ipoclorito dì sodio (0,1 g L-1 di cloro): Diluire opportunamente al momento dell'uso
una soluzione commerciale a titolo noto.
Soluzione di perossido d'idrogeno [H2O2] al 30%.
Sali
Acetato di ammonio
Acetato di piombo
Carbonato di calcio
Carbonato di sodio
Soluzione 30g/L - Sciogliere 30 g di carbonato di sodio in acqua e diluire a 1.000 mL.
Cloruro d’ammonio
Cloruro di sodio
Cloruro di potassio KCl
Soluzione di cloruro di bario. Sciogliere 100 g di cloruro di bario in un litro d'acqua.
Soluzione di cromato di potassio. Sciogliere 50 g di cromato di potassio in poca acqua,aggiungere nitrato di argento fino ad incipiente formazione di precipitato rosso. Lasciare sedimentare per circa 12 ore, filtrare e portare il filtrato a 1L con acqua.
Diidrogenofosfato di potassio
Soluzione concentrata Sciogliere con acqua 0,4393 g di diidrogenofosfato di potassio anidro [KH2PO4], seccato a 105°C, e diluire con acqua a 1.000 mL in matraccio tarato. Conservare la soluzione in bottiglia scura, previa aggiunta di 1 mL di cloroformio. La soluzione è stabile per molti mesi.
EDTA
Soluzione 0,01M - si ottiene in un matraccio da 1L sciogliendo 3,752 g di EDTA sodico solido con acqua distillata fino al volume di 1L.Si trova anche in commercio già pronta.
Fluoruro di sodio anidro (NaF)

Fosfato disodico dodecaidrato
Fosfato monopotassico
Ioduro di potassio(1gL-1): Sciogliere 100 mg di ioduro di potassio in 100 mL di acqua.
Conservare la soluzione in bottiglia di vetro scura preferibilmente in frigorifero; scartare la soluzione quando si sviluppa un colore giallo.
Soluzione di lantanio (10% La). Sciogliere 117,276 g di ossido di lantanio in poca acqua,aggiungere 250 mL di acido cloridrico concentrato e portare a volume di 1.000 mL con acqua.magnesio metallico
Molibdato di ammonio Soluzione Sciogliere 15 g di eptamolibdato (VI) di esammonio tetraidrato in 500 mL di acqua. La soluzione conservata in bottiglie di polietilene fuori del contatto della luce, è stabile per molti mesi.
Nitrato d'argento Soluzione 0,1 N. Sciogliere circa 17 g di nitrato d'argento in acqua e trasferire quantitativamente in un matraccio tarato da 1.000 mL. Portare a volume con acqua, avendo cura di ben omogeneizzare la soluzione.
Nitrato di potassio
Nitrito di sodio
Nitroprussiato di sodio
Ossido di zinco
Permanganato di potassio: Sciogliere 0,891 g di permanganato di potassio in un matraccio tarato da 1.000 mL e portare a volume con acqua.

Soluzione di curcumina. Sciogliere 0,125 g di curcumina [C21H20O6] in 100 mL di acido acetico glaciale. Conservare in flacone di polietilene. La soluzione deve essere utilizzata entro 24 ore.
Soluzione di naftiletilendiammina allo 0,1% (m/v). Sciogliere 0,1 g di dicloruro di N-(1-naftil)-etilendiammonio [C12H16Cl2N2•CH3OH] in 100 mL di acqua. La soluzione, conservata in bottiglia scura, è stabile per un mese; comunque va rinnovata quando imbrunisce.
N,N-dietil-p-fenilendiammina solfato pentaidrato Soluzione di N,N-dietil-p-fenilendiammina (DPD):Sciogliere 1,5 g di N,N-dietil-p-fenilendiammina solfato pentaidrato in acqua insieme a 8 mL di acido solforico (1+3) e 200 mg di EDTA. Diluire a 1.000 mL con acqua. Conservare la soluzione in bottiglia di vetro scuro e scartare le soluzioni eventualmente colorate.
Rame elettrolitico
Salicilato di sodioSciogliere 0,5 g di salicilato di sodio e portare a 100 mL con acqua. La soluzione va preparata al momento dell'uso.
Soluzione di solfanilammide all'1% (m/v). Sciogliere, subito dopo la pesata, 1 g di solfanilammide
[C6H8N2O2S] in una soluzione contenente 10 mL di acido cloridrico concentrato e 70 mL di acqua. Diluire a 100 mL con la stessa acqua. Il prodotto solido può alterarsi all'aria e alla luce.La soluzione, conservata in bottiglia scura, è stabile per molti mesi.
Solfato di magnesio eptaidrato
Soluzione di tartrato di sodio e potassio e di idrossido di sodio. Sciogliere 400 g di NaOH e 60 g di
tartrato di sodio e potassio, raffreddare e portare a 1.000 mL con acqua. La soluzione va conservata in contenitore di polietilene.
Solfato di manganese(II) monoidrato tartrato di sodio e potassio
Tartrato di ossido di antimonio(III) e di potassio emiidratoSoluzione Sciogliere 0,34 g di tartrato di ossido di antimonio(III) e di potassio emiidrato in 250 mL di acqua, scaldando se necessario. La soluzione, conservata in bottiglie di vetro o di plastica, è stabile per molti mesi.
Indicatori
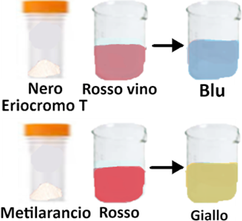
Nero eriocromo T - Aggiungere 1 mL di una soluzione (30 g/L) di carbonato di sodio a 30 mL di acqua e quindi 1 g di nero eriocromo T. Aggiustare il pH a 10,5 con la soluzione di carbonato di sodio e portare la soluzione a 100 mL con alcool etilico al 95%. La soluzione viene conservata in bottiglia scura.
Metilarancio. Sciogliere 0,05 g di metilarancio in acqua e diluire a 100mL.
Soluzioni tampone

Tampone pH 10. Sciogliere 1,179 g di sale bisodico dell'EDTA e 0,78 g di solfato di magnesio eptaidrato in 50 mL di acqua. Aggiungere 16,9 g di cloruro d’ammonio e 143 mL di idrossido d’ammonio concentrato Diluire a 250 mL con acqua. Conservare in bottiglia di politene ben chiusa.
Soluzione tampone (pH 6,5). Sciogliere 24 g di fosfato bisodico e 46 g di fosfato monopotassico in acqua, aggiungere 100 mL di acqua in cui sono stati sciolti 0,8 g di sale disodico dell'acido etilendiamminotetracetico [EDTA] e diluire il tutto a 1L con acqua. La soluzione deve essere conservata in frigorifero per evitare che lo sviluppo di muffe provochi interferenze nella determinazione.
Soluzione tampone (pH 4,6). Sciogliere 250 g di acetato di ammonio in 300 mL di
acido acetico glaciale e portare a 1.000 mL con acqua. Il pH finale deve
risultare 4,6. Conservare il reattivo in flacone di polietilene.
Soluzioni Standard
Sono soluzioni a concentrazione nota e molto accurata che vengono utilizzate,dopo diluizione,per costuire le rette di taratura in spettrometria. Sono necessariamente da acquistare,in genere da 100ml contenenti gli elementi alla concentrazione di 1000 ppm. Poichè costose si possono anche preparare ma occorre essere molto precisi.
DETERMINAZIONI ANALITICHE
Conducibilità elettrica EC

La conducibilità elettrica (o conduttività)è un parametro fisico che esprime una misura della concentrazione delle specie ioniche presenti in soluzione,ossia indica se un'acqua è ricca o povera di sali minerali che,essendo in forma ionica,sono in grado di condurre elettricità.In termini pratici la conducibilità esprime il rischio che l'acqua irrigua aumenti la salinità del suolo con conseguente danno per le colture. Tuttavia non è possibile stabilire dei valori di riferimento precisi,poichè le colture sono diversamente sensibili alla salinità e nel suolo l'accumulo di sali dipende da svariati fattori,come la tessitura e la piovosità.Il contenuto in sali nell'acqua influisce anche sul pericolo di otturazione dell'impianto irriguo.
In seguito viene riportato il metodo ufficiale di analisi ma è possibile anche misurare la conducibilità elettrica con dei conduttivimetri portatili o da banco di buona qualità.
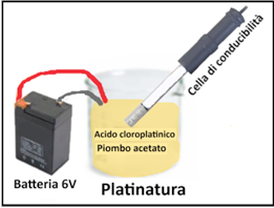
Per la misura si utilizzano Celle di conducibilità i cui elettrodi,se nuovi,devono essere puliti con una soluzione costituita da 1 parte di alcool isopropilico,una di etere etilico e 1 parte di HCl 1:1 . In seguito,gli elettrodi,quando anneriti,devono essere puliti con acqua regia (3 parti di HCl e 1 parte di Acido nitrico entrambi concentrati) sciacquati e riplatinati con una soluzione contenente 5 g di acido cloroplatinico (costoso) e 0,0125g di acetato di piombo in 50 mL di acqua. Si immergono gli elettrodi nella soluzione e si lascia passare corrente da una batteria da 6 V attraverso la cella.Il deposito di nero di platino deve aderire bene alla superficie degli elettrodi.
 Con la cella di conducibilità, preventivamente lavata con acqua distillata ed asciugata, si procede alla determinazione diretta della conducibilità.
Con la cella di conducibilità, preventivamente lavata con acqua distillata ed asciugata, si procede alla determinazione diretta della conducibilità.EC(25 °C) = J • ECx
dove
J=costante di cella leggibile sul libretto di istruzioni
ECx=conducibilità del campione
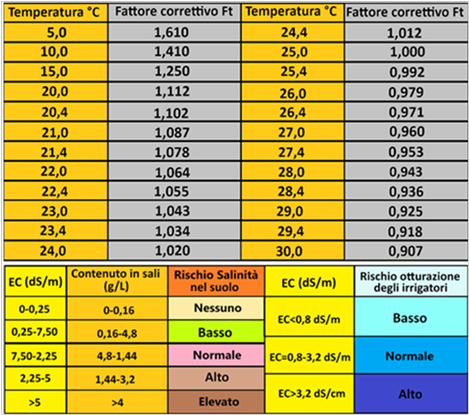
La misurazione deve essere eseguita con il campione d'acqua a 25 °C;in caso contrario occorre utilizzare un fattore correttivo e di conseguenza: EC = EC • ft
L'unità di misura della conducibilità è il dS/m (decisievert/metro) ma molto spesso si utilizza anche il µS/cm(microsievert/centimetro) sapendo che 1dS/m=1000µS/cm. A volte si utilizza anche il mS/cm che ha un valore identico al dS/m.
Dalla misura della Conducibilità elettrica si può calcolare il contenuto totale di sali nell’acqua,tenendo presente che se EC ha valore minore di 5dS/m si utilizza un coefficiente pari a 0,64 mentre se EC ha valore maggiore di 5dS/m si utilizza un coefficiente pari a 0,8. Per es. se il valore di EC misurato è pari a 3 dS/m,il contenuto di sali è pari a: Q=EC*0,64=3*0,64=1,92g/L. Se il valore di EC misurato è pari a 5,5 dS/m,il contenuto di sali è pari a: Q=EC*0,8=5,5*0,8=4,4g/L.
Solidi totali disciolti STD
Per Solidi Totali Disciolti (o residuo filtrabile) si intendono tutte le sostanze non trattenute da un filtro da 0,45 μm e che non sono volatilizzate durante il processo d'essiccamento.
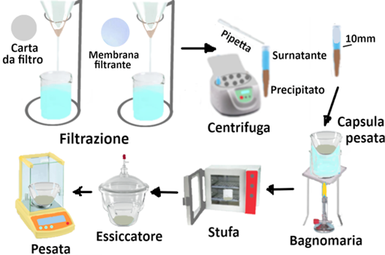
Determinazione gravimetrica
Filtrare con Carta da filtro di tipo duro, senza ceneri, e successivamente attraverso una membrana filtrante con pori di diametro non superiore a 0,45 μm.Centrifugare il campione per 15 minuti, mantenendo a 3.000 giri/minuto,prelevare il surnatante lasciandone al di sopra del deposito una quantità di circa 10 mm.
Trasferire una porzione C di liquido limpido in una capsula precedentemente pesata ed evaporare a bagnomaria. Dopo completa evaporazione dell'acqua trasferire la capsula in stufa alla temperatura di 103-105 °C ed essiccare fino a peso costante. Raffreddare la capsula all'aria prima di porla ancora calda in un essiccatore per completare il raffreddamento.Pesare la capsula non appena sia completamente raffreddata.
La concentrazione in sali disciolti del campione si calcola mediante la formula:
STD=(p1-p0) • 1.000/C
dove:
p1 = peso della capsula piena;
p0 = peso della capsula vuota;
C = volume del campione filtrato (o centrifugato) prelevato per l'analisi (mL).
Il risultato si esprime in mg/L.
Solfati
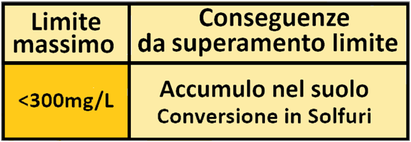
Reagenti
Soluzione di indicatore al metilarancio. Sciogliere 0,05 g di metilarancio in acqua e diluire a 100mL.
Acido cloridrico 1:1. Diluire l'acido cloridrico concentrato con un ugual volume di acqua.
Soluzione di cloruro di bario. Sciogliere 100 g di cloruro di bario diidrato in un litro d'acqua.
Reattivo nitrato d'argento-acido nitrico. Sciogliere 8,5 g di nitrato d'argento e 0,5 mL di acido nitrico concentrato in 500 mL di acqua.
Acido solforico concentrato.
Perossido d'idrogeno al 30%.
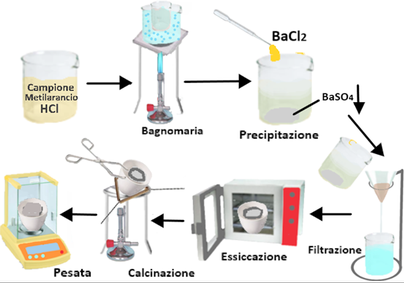
Determinazione gravimetrica
Prelevare una porzione d'acqua in esame,aggiungere qualche goccia di indicatore al metilarancio e quindi acido cloridrico 1:1 fino a viraggio. Portare il volume a 200mL per diluizione con acqua o per evaporazione. Aggiungere ancora 2 mL di acido cloridrico 1:1.Riscaldare il campione quasi all'ebollizione e sotto agitazione aggiungere lentamente la soluzione bollente di cloruro di bario fino a precipitazione completa. Aggiungere altri 2 mL di soluzione di cloruro di bario a temperatura vicina all'ebollizione. Far digerire il precipitato bianco di solfato di bario a 80°C, per almeno due ore. Filtrare su filtro di carta e lavare il precipitato con acqua calda fino a che le acque di lavaggio siano praticamente esenti da cloruri (reattivo acido nitrico-nitrato d'argento). Seccare il filtro con il precipitato e trasferire il tutto in un crogiolo di porcellana portato a peso costante;carbonizzare il filtro lentamente, evitando che s'infiammi mantenendo il crogiolo inclinato. Calcinare quindi a 800°C per circa un'ora, avendo cura che il carbone sia completamente scomparso. Raffreddare in essiccatore e pesare fino a peso costante.
La concentrazione dello ione solfato è data da:
SO42-=(P2-P1)•411,6/V
dove:
P2-P1=peso del solfato di bario in mg;
V = volume del campione di acqua espresso in mL.
Il risultato si esprime in mg/L.
Cloruri

Soluzione standard di nitrato d'argento 0,1 N. Sciogliere circa 17 g di nitrato d'argento in
acqua e trasferire quantitativamente in un matraccio tarato da 1L. Portare a volume con
acqua, avendo cura di ben omogeneizzare la soluzione.
Soluzione di cromato di potassio. Sciogliere 50 g di cromato di potassio in poca acqua,aggiungere nitrato di argento fino ad incipiente formazione di precipitato rosso. Lasciare sedimentare per circa 12 ore, filtrare e portare il filtrato a 1L con acqua.
Soluzione di acido solforico 0,5 M. Aggiungere molto lentamente e sotto raffreddamento 28 mL di
acido solforico concentrato a 500 mL di acqua. Dopo raffreddamento diluire a 1L con acqua.
Soluzione di idrossido di sodio 1 M. Sciogliere 40 g di idrossido di sodio in acqua e diluire ad 1L.
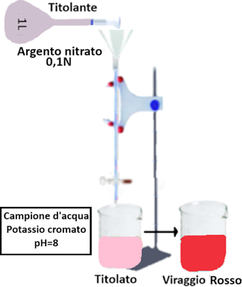
Titolazione
Prelevare 100 mL esatti di campione e verificare che il campione si trovi intorno a pH 8,0. Se così non fosse, aggiustare il valore mediante acido solforico 0,5 M o idrossido di sodio 1 M.Aggiungere 1 mL di soluzione di cromato di potassio e titolare con la soluzione standard di nitrato d’argento 0,1 N, fino a viraggio rosso persistente.
È indispensabile eseguire, nelle stesse condizioni, una prova in bianco su un’aliquota di 100 mL di acqua, trattata in modo analogo al campione.
La concentrazione degli ioni cloruro nel campione è data dalla formula:
Cl- (meq L-1) =(a - b) • N• 1.000/C
dove:
a = volume, in mL, di soluzione standard di AgNO3 consumata per la titolazione del campione;
b = volume. in mL, di soluzione standard di AgNO3, consumata per la titolazione del bianco;
N = la normalità della soluzione standard di AgNO3;
C = il volume, in mL, del campione d'acqua prelevato.
Per avere la concentrazione in mg L-1:
Cl- (mg L-1) = Cl- (meq L-1) • 35,45
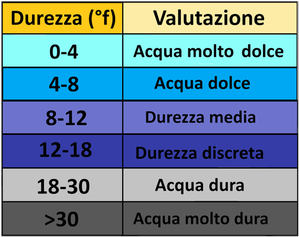
Durezza totale
Per durezza di un'acqua si intende la quantità di cationi multivalenti in essa contenuti; poiché i cationi multivalenti presenti in quantità rilevante sono gli ioni Ca++ e Mg++, col termine durezza si indica in senso stretto la loro concentrazione.
Reagenti:
Soluzione di EDTA sodico 0,01 M
Indicatore nero eriocromo T.
Soluzione tampone pH 10. Sciogliere 1,179 g di sale bisodico dell'EDTA e 0,78 g di solfato di magnesio eptaidrato in 50 mL di acqua. Aggiungere 16,9 g di cloruro d’ammonio e 143 mL di idrossido d’ammonio concentrato Diluire a 250 mL con acqua. Conservare in bottiglia di politene ben chiusa.
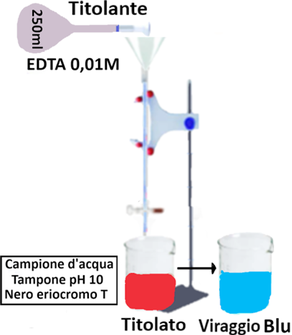
Titolazione
Trasferire 25ml di campione in una capsula di porcellana e diluire con 50 ml di acqua distillata,aggiungere 1 mL di soluzione tampone a pH 10 e 1-2 gocce di nero eriocromo T. Titolare immediatamente con EDTA agitando continuamente finchè il colore passa da rosso al blu.
La Durezza totale si ricava con la formula:
Ca++ e Mg++=(a • T • 1.000/C)*100
dove:
a = volume (mL) di soluzione titolante;
T = titolo della soluzione di EDTA (mmol L-1);
C = volume (mL) di campione prelevato.
Il risultato del contenuto in Ca++ e Mg++ si esprime in mg/L.La durezza dell’acqua viene espressa in gradi francesi (°f) che corrispondono a 10 mg/L di CaCO3. Si procede con il seguente calcolo:
Ca++* 2,5 + Mg+* 4,1=mg/L di CaCO3
°f=mg/Ldi CaCO3/10
Carbonati e Bicarbonati

Titolazione potenziometrica
Reagenti
Soluzione standard di acido cloridrico 0,02 N. Aggiungere 1,7 mL di acido cloridrico concentrato
[HCl] (d = 1,19) a 100 mL di acqua distillata e diluire a 1L.
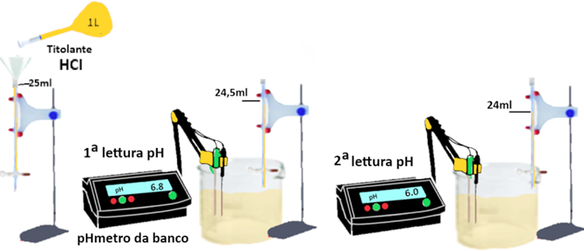
Lavare accuratamente gli elettrodi del pH metro in un becker con acqua distillata e asciugare.
Introdurre nel becker un volume noto di campione (C). Aggiungere la soluzione titolante (soluzione standard di HCl 0,02 N) da una buretta. Il volume di una singola aggiunta non deve superare 0,5 mL. Dopo ogni aggiunta agitare la soluzione e leggere il pH. Continuare la titolazione fino all'ottenimento dei dati necessari per costruire la curva di titolazione completa.
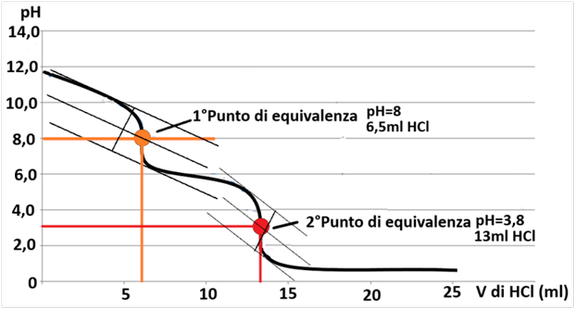
Tracciare la curva di titolazione riportando i valori di pH letti in funzione del volume di titolante aggiunto.
Detto A il volume (mL) di HCl standard di normalità N usato per raggiungere il primo punto di equivalenza (primo flesso della curva di titolazione) e B quello totale (incluso il volume A)necessario per il secondo punto di equivalenza (secondo flesso), ricavare i valori di P e T con le seguenti formule:
P (meq L-1) =A • N • 1.000/C Iº Punto di equivalenza
T (meq L-1) =B • N • 1.000/ C IIº Punto di equivalenza
dove:
C = volume (mL) di campione prelevato;
A =volume (mL) di HCl 0,02 N utilizzato per raggiungere il I° punto diequivalenza;
B =volume totale (mL) di HCl 0,02 N utilizzato per raggiungere il II° puntodi equivalenza;
N = normalità dell’acido cloridrico.
Di conseguenza si ha:
HCO3- (meq L-1) = T-2P CO3= (meq L-1) = 2P
Se la curva di titolazione inizia a pH inferiore a 8-8,3, si avrà un solo flesso intorno a pH 4-5.
Di conseguenza sarà P = 0, cioè sono presenti solo bicarbonati. D'altra parte, se è T = 2P sono
presenti solo carbonati.
Azoto ammoniacale

Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere trasferito in bottiglie di vetro,conservato a 4°C ed analizzato possibilmente entro 24 ore, oppure congelato.
Reagenti
Idrossido di sodio 0,1M: sciogliere 4g di Idrossido di sodio in acqua distillata fino a un volume di 1L. Conservare in bottiglia di plastica.
Soluzione di Nitroprussiato di sodio e Salicilato di sodio: sciogliere 0,5g di nitroprussiato sodico e in 42,5g di Salicilato di sodio in 250ml di acqua distillata.NaOH 0,1 M. La soluzione è utilizzabile entro 15 giorni se conservata in bottiglia di vetro scuro.
Soluzione alcalina di Citrato di sodio 200g/L: sciogliere 100g di Citrato trisodico diidrato e 10g di Idrossido di sodio in acqua distillata fino a un volume di 500ml. La soluzione è utilizzabile entro 6 mesi se conservata in bottiglia di plastica.
Soluzione di Dicloroisocianurato di sodio 5,8g/L: sciogliere 0,116g di Dicloroisocianurato di sodio in 20ml di acqua distillata. Preparare al momento dell’uso.
Soluzione ossidante: miscelare 80ml di Soluzione alcalina di Citrato di sodio con 20ml di Soluzione di Dicloroisocianurato di sodio.Preparare al momento dell’uso.
Soluzione concentrata di Cloruro d’ammonio: sciogliere 1,483g di cloruro di ammonio anidro, preventivamente essiccato a 100°C e portato a peso costante, in acqua distillata fino a volume di 1L in un matraccio.1ml di soluzione contiene 0,5mg di NH4+ (in 1L=1000ml=1000*0,5=500mg)
Soluzione diluita di Cloruro d’ammonio:in un matraccio da 1L trasferire 10 ml di soluzione concentrata di Cloruro d’ammonio e portare a volume con acqua distillata.1ml di soluzione contiene 0,005mg di NH4+ (in 1L=1000ml=1000*0,005=5mg)
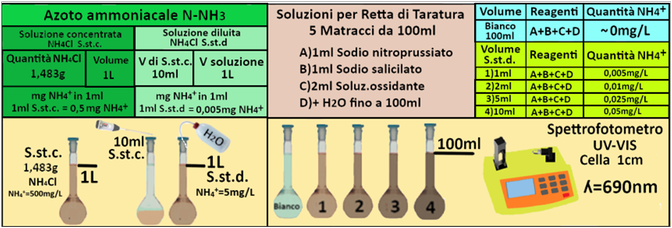
In 4 matracci da 100ml trasferire rispettivamente 1-2-5 e 10ml di soluzione diluita di Cloruro d’ammonio e
addizionare 2 mL di soluzione di nitroprussiato di sodio e salicilato di sodio e 2 mL di soluzione ossidante.Portare a volume di 100ml con acqua distillata.Introdurre i matracci in
un bagnomaria per 3 minuti. Le soluzioni assumono colorazione verde-azzurro.
Allo stesso modo preparare un bianco sempre da 100ml che contenga tutti i reagenti precedentemente descritti ma senza la soluzione diluita di azoto ammoniacale.
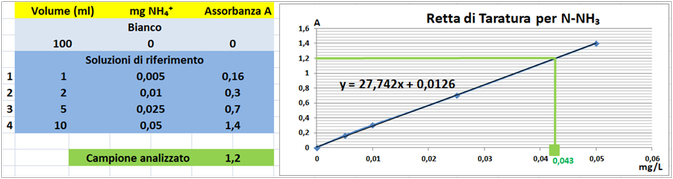
Costruire la retta di taratura
utilizzando uno spettrofotometro alla lunghezza d'onda di 690nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Azoto ammoniacale nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,005-0,01-0,025 e 0,05 mg/L.
Prelevare 50 mL di campione d'acqua da analizzare,misurare il pH ed eventualmente correggerlo fino a renderlo neutro con idrossido di sodio o acidi concentrati .Trasferire il campione in un matraccio da 100 mL e addizionare 2 mL di soluzione di nitroprussiato di sodio e salicilato di sodio e 2 mL di soluzione ossidante.Portare a volume di 100ml con acqua distillata.Introdurre il matraccio in un bagnomaria per 3 minuti. La soluzione assume colorazione verde-azzurro.
Misurare l'assorbanza della soluzione campione a λ=690 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Azoto ammoniacale in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 1,2,graficamente si ricava che la concentrazione di Azoto ammoniacale è pari a 0,043mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=27,742x+0,0126 (1,2=27,742x+0,0126 x=0,043mg/L).
Poichè il campione d'acqua è di 50ml si ha che: (50*0,043)/1000=0,00215mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Azoto ammoniacale pari a 1000000L*0,00215mg/L=2150mg=2,15g
Possibili interferenze nell'analisi:
Possibili interferenze nell'analisi:generalmente non rilevanti.
Azoto nitrico
Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere trasferito in bottiglie di vetro o plastica,conservato a 4°C ed analizzato possibilmente entro 48 ore, oppure congelato.
Reattivi
Soluzione di salicilato di sodio. Sciogliere 0,5 g di salicilato di sodio e portare a 100 mL con acqua. La soluzione va preparata al momento dell'uso.
Soluzione di tartrato di sodio e potassio e di idrossido di sodio. Sciogliere 400 g di NaOH e 60 g di
tartrato di sodio e potassio, raffreddare e portare a 1.000 mL con acqua. La soluzione va conservata in contenitore di polietilene.
Acido solforico concentrato.
Soluzione di idrossido di sodio 1 N.
Soluzione di idrossido di sodio 0,1 N.
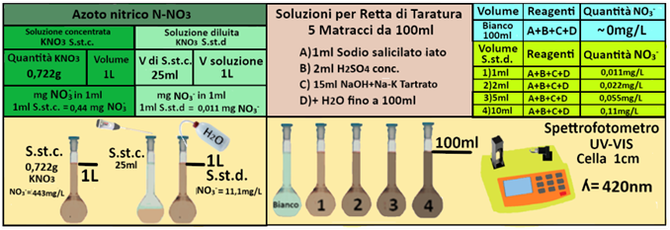
Soluzione standard concentrata di nitrato di potassio.Sciogliere 0,722 g di nitrato di potassio anidro, aggiungere 1 mL di cloroformio e portare a 1L con acqua in matraccio tarato.1ml di soluzione contiene 0,444mg di NO3- (in 1L=1000ml=1000*0,44=443mg)
Soluzione standard diluita di nitrato di potassio. Introdurre 25 mL della soluzione concentrata di nitrato di potassio in matraccio tarato da 1L e portare a volume con acqua distillata.1ml di soluzione contiene 0,011mg di NO3- (in 1L=1000ml=1000*0,011=11,1mg)
Prelevare e trasferire in 5 capsule di porcellana da 60ml 1-2-5-10ml della soluzione diluita di azoto nitrico e portare a volume di 10 mL con acqua.aggiungere 1 mL di soluzione di
salicilato di sodio ed evaporare a secco su bagnomaria bollente. Lasciare raffreddare e riprendere il
residuo con 2 mL di H2SO4 concentrato, inclinando e ruotando
la capsula in modo da inumidire completamente il residuo. Lasciare a riposo 10 minuti, aggiungere 15 mL di acqua e poi 15 mL di
soluzione di idrossido di sodio e tartrato di sodio e potassio che provoca lo sviluppo della
colorazione gialla.Portare a volume di 100ml con acqua distillata.Preparare un bianco che contenga gli stessi reagenti ma senza la soluzione diluita di azoto nitrico
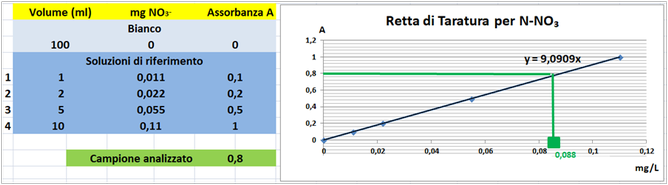
Costruire la retta di taratura utilizzando uno spettrofotometro alla lunghezza d'onda di 420nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Azoto nitrico nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,011–0,022–0,055-0,11mg/L.
Trasferire 10 mL di campione,portato a pH 7 in capsula di porcellana da 60 mL. Alcalinizzare
debolmente con una goccia di soluzione di NaOH 0,1 N, aggiungere 1 mL di soluzione di salicilato
di sodio ed evaporare a secco su bagnomaria bollente. Lasciare raffreddare e riprendere il residuo
con 2 mL di H2SO4 concentrato, inclinando e ruotando la capsula in modo da inumidire
completamente il residuo. Lasciare a riposo 10 minuti, aggiungere 15 mL di acqua e poi 15 mL di
soluzione di idrossido di sodio e tartrato di sodio e potassio che provoca lo sviluppo della
colorazione gialla.Portare a volume di 100ml con acqua distillata
Misurare l'assorbanza della soluzione campione a λ=420 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Azoto nitrico in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,8,graficamente si ricava che la concentrazione di Azoto nitrico è pari a 0,088mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=9,0909x (0,8=9,0909x x=0,088mg/L).
Poichè il campione d'acqua è di 10ml si ha che: (10*0,088)/1000=0,00088mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Azoto nitrico pari a 1000000L*0,00088mg/L=880mg
Possibili interferenze nell'analisi:
Cloruri-interferiscono se presenti con una concentrazione di 400 mg/L. Trattare 100 mL di campione con
100 mL di soluzione di solfato di argento;eliminare il precipitato di cloruro d'argento per filtrazione.
Ferro- interferisce se presente con una concentrazione di 5mg/L.Trattare il campione con ossido di zinco e filrare.
Nitriti- interferiscono se presenti con una concentrazione di 2mg/L.Aggiungere al campione 0,05 g di solfato di ammonio.
Azoto nitroso

Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere analizzato in tempi brevi e raccolto in contenitori riempiti completamente al riparo dalla luce.
Acido cloridrico concentrato [HCl] (d = 1,18).
Soluzione di solfanilammide all'1%. Sciogliere 1 g di solfanilammide in una soluzione contenente 10 mL di acido cloridrico concentrato e 70 mL di acqua. Diluire a 100 mL con la stessa acqua. La soluzione, conservata in bottiglia scura, è stabile per molti mesi.
Soluzione di naftiletilendiammina allo 0,1%. Sciogliere 0,1 g di dicloruro di N-(1-naftil)-etilendiammonio in 100 mL di acqua. La soluzione, conservata in bottiglia scura, è stabile per un mese.
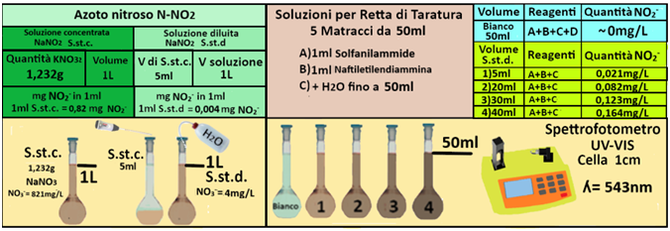
Soluzione standard concentrata di Nitrito di sodio (1 mL=0,821 mg di N-NO2). Pesare 1,232 g di nitrito di sodio anidro seccato a 110°C per 1 ora; sciogliere con acqua e diluire a 1L con acqua in un matraccio. 1ml di soluzione contiene 0,821mg di NO2- (in 1L=1000ml=1000*0,821=821mg) Se conservata al buio con l'aggiunta di 1 mL di cloroformio la soluzione è stabile per un mese.
Soluzione standard diluita di Nitrito di sodio (1 mL ≈ 0,025 μg di N-NO2). Prelevare 5 mL di
soluzione standard diluita e diluire a 1L con acqua in un matraccio.1ml di soluzione contiene 0,004mg di NO2- (in 1L=1000ml=1000*0,004=4mg) La soluzione va preparata al momento dell'uso.
In 4 matracci da 50ml trasferire rispettivamente 5-20-30 e 40ml di soluzione diluita di Nitrito di sodio e aggiungere acqua fino a 40 mL e, agitando dopo ogni aggiunta, 1
mL di soluzione di solfanilammide all'l% e, dopo 2÷3 minuti, 1 mL di soluzione di naftiletilendiammina allo 0,1%. Diluire a 50 mL con acqua e lasciare sviluppare il colore
per 10÷15minuti. Allo stesso modo preparare un bianco sempre da 50ml che contenga tutti i reagenti precedentemente descritti ma senza la soluzione diluita di Nitrito di sodio.
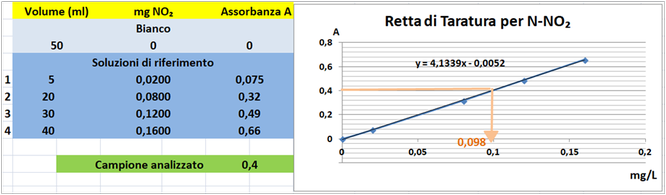
Costruire la retta di taratura utilizzando uno spettrofotometro alla lunghezza d'onda di 543nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Azoto nitroso nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,021-0,082-0,123 e 0,164 mg/L.
Prelevare 20 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 50 mL e aggiungere acqua fino a 40 mL e, agitando dopo ogni aggiunta, 1
mL di soluzione di solfanilammide all'l% e, dopo 2÷3 minuti, 1 mL di soluzione di
naftiletilendiammina allo 0,1%. Diluire a 50 mL con acqua e lasciare sviluppare il colore per 10÷15
minuti.
Misurare l'assorbanza della soluzione campione a λ=543 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Azoto nitroso in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,4,graficamente si ricava che la concentrazione di Azoto nitroso è pari a 0,098mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=4,1339x-0,0052 (0,4=4,1339x-0,0052 x=0,098mg/L).
Poichè il campione d'acqua è di 20ml si ha che: (20*0,098)/1000=0,00196mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Azoto nitrico pari a 1000000L*0,00196mg/L=1960mg
Possibili interferenze nell'analisi:
Rame- interferisce se presente con una concentrazione di 0,5 mg/L.
Cloro libero
Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere analizzato in tempi brevi e raccolto in contenitori riempiti completamente al riparo dalla luce e a temperatura di 4°C .
Reagenti:
Sale sodico diidrato dell'acido etilendiamminotetracetico (EDTA).
Soluzione tampone (pH 6,5). Sciogliere 24 g di fosfato bisodico e 46 g di fosfato monopotassico in acqua, aggiungere 100 mL di acqua in cui sono stati sciolti 0,8 g di sale disodico dell'EDTA e diluire il tutto a 1L con
acqua. La soluzione deve essere conservata in frigorifero.
Soluzione di acido solforico (1:3): Aggiungere lentamente 25 mL di acido solforico concentrato a 50 mL di acqua. Dopo raffreddamento, diluire a 100 mL con acqua.
Soluzione di N,N-dietil-p-fenilendiammina (DPD):Sciogliere 1,5 g di N,N-dietil-p-fenilendiammina
solfato pentaidrato in acqua insieme a 8 mL di acido solforico (1:3) e 200 mg di EDTA. Diluire
a 1L con acqua. Conservare la soluzione in bottiglia di vetro scuro.
Soluzione di ipoclorito dì sodio (0,1 g/L di cloro): Diluire opportunamente al momento dell'uso
una soluzione di ipoclorito dì sodio al 15%(15g di Cl2/100ml).

In 4 matracci da 100ml trasferire rispettivamente 5-10-30 e 40ml di soluzione di Ipoclorito di sodio.In altri 4 matracci porre 5 mL della soluzione tampone (pH 6,5) e 5 mL della soluzione di DPD; entro
1 minuto trasferire il contenuto dei matracci da 100 mL e agitare fino a colore sviluppato.
Allo stesso modo preparare un
bianco sempre da 100ml che contenga tutti i reagenti precedentemente descritti ma senza la soluzione diluita di Ipoclorito di sodio.
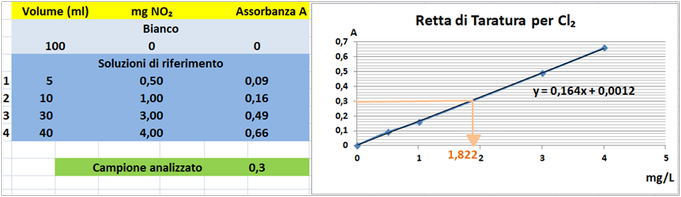
Costruire la retta di taratura il prima possibile utilizzando uno spettrofotometro alla lunghezza d'onda di 510nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Azoto nitroso nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,5-1-3 e 4 mg/L.
Prelevare 50 mL di campione d'acqua da analizzare,trasferirlo in un matraccio da 100 mL e aggiungere 5 mL di soluzione tampone (pH 6,5) e 5 mL di soluzione di DPD.Controllare che il pH della soluzione di misura sia compreso tra 6,2 e 6,5; in caso contrario aumentare l'aggiunta di tampone.
Misurare l'assorbanza della soluzione campione a λ=510 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Cloro libero in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,3,graficamente si ricava che la concentrazione di Cloro libero è pari a 1,822mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=0,164x+0,0012 (0,3=0,164x+0,0012 x=1,822mg/L). Poichè il campione d'acqua è di 50ml si ha che: (50*1,822)/1000=0,0911mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Azoto nitrico pari a 1000000L*0,0911mg/L=91100mg=91,1g
Possibili interferenze nell'analisi: non rilevanti.
Floruri
Determinazione potenziometrica
Reagenti
Soluzione di riferimento di NaF - Sciogliere 221,1 mg di fluoruro di sodio anidro (seccato a 105°C per due ore e raffreddato in essiccatore) e diluire a 1L con acqua.Diluire 1,0 mL - 5,0 mL - 10,0 mL e 20,0 mL della soluzione precedente a 1 litro, ottenendo soluzioni di lavoro con le seguenti concentrazioni in fluoruro:0,1 mg/L - 0,5 mg/L - 1 mg/L - 2 mg/L Le soluzioni devono essere conservate in bottiglie di di plastica.
Soluzioni tampone Aggiungere a circa 500 mL di acqua distillata 57 mL di acido acetico glaciale, 58 g di cloruro di sodio e 0,30 g di citrato di sodio diidrato. Dopo aver agitato bene la soluzione per
facilitare la dissoluzione dei composti aggiunti, questa viene raffreddata a temperatura ambiente
e portata a pH 5,0-5,5 con circa 150 mL di una soluzione di NaOH 5 M.Trasferire la soluzione in un pallone da 1 L e portare a volume.
Soluzione di idrossido di sodio 5 M - Sciogliere in 1 L di acqua circa 200 g di idrossido di sodio .
Acido acetico glaciale (d=1,05)
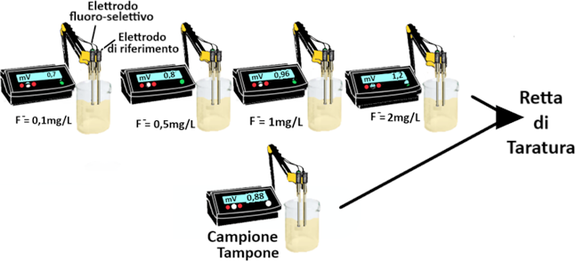
Introdurre 10 mL di ciascuna delle soluzioni di fluoruro 0,1 mg/L - 0,5 mg/L - 1 mg/L - 2
mg/L in un becker insieme a 10 mL della soluzione tampone . Agitare la soluzione
per 30 secondi e misurare la f.e.m. in quiete, dopo che il suo valore si è stabilizzato. Quando il segnale si è stabilizzato il valore misurato viene riportato in ordinata in funzione del logaritmo della concentrazione, tracciando la retta che passa fra i quattro punti sperimentali.
Prelevare 10 mL del campione in esame e aggiungere 10 mL della soluzione tampone.
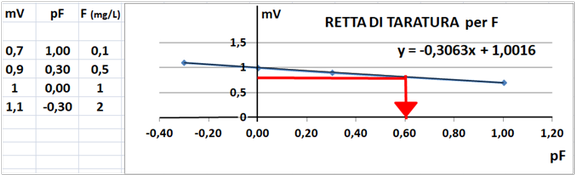
Misurare la f.e.m. e tramite la retta di taratura ricavare la concentrazione dello ione fluoruro nel campione.
Boro

Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere raccolto in contenitori di plastica.
Reagenti
Soluzione tampone (pH 4,6). Sciogliere 250 g di acetato di ammonio in 300 mL di acido acetico glaciale e portare a 1L con acqua. Il pH finale deve risultare 4,6. Conservare il reattivo in flacone di plastica.
Reattivo acido. Miscelare con precauzione 50 mL di acido acetico glaciale con 50 mL di acido solforico concentrato. Conservare il reattivo in flacone di plastica.
Soluzione di curcumina. Sciogliere 0,125 g di curcumina in 100 mL di acido acetico glaciale. Conservare in flacone di plastica.La soluzione deve essere utilizzata entro 24 ore.
Soluzione standard concentrata di boro (0,1g/L):in un matraccio da 1L sciogliere 0,5716 g di acido borico anidro e portare a volume con acqua distillata. Preparare al momento dell'uso.
Soluzione diluita di boro (1mg/L): Prelevare 10 mL di soluzione standard concentrata e diluire a 1L con acqua in un matraccio.1ml di soluzione contiene 0,001mg di B(in 1L=1000ml=1000*0,001=1mg).
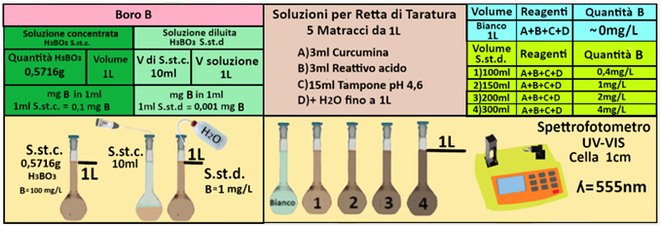
In 4 matracci da 1L trasferire rispettivamente 100-150-200 e 300ml di soluzione diluita di Acido borico e aggiungere 3 mL di soluzione di curcumina e 3 mL di soluzione di reattivo
acido, mescolare e dopo 45 minuti aggiungere 15 mL di soluzione tampone. Attendere 30 minuti per consentire lo sviluppo del colore.
Portare a volume di 1L con acqua distillata. Allo stesso modo preparare un bianco sempre da 1L che contenga tutti i reagenti precedentemente descritti ma senza la soluzione diluita di Acido borico.
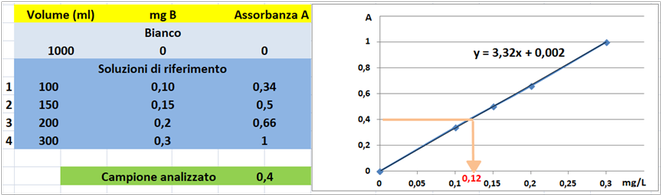
Costruire la retta di taratura utilizzando uno spettrofotometro alla lunghezza d'onda di 555nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Boro nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,1-0,15-0,2 e 0,3 mg/L.
Prelevare 1 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 1L e aggiungere 3 mL di soluzione di curcumina e 3 mL di soluzione di reattivo acido, mescolare e dopo 45 minuti aggiungere 15 mL di soluzione tampone. Attendere 30 minuti per consentire lo sviluppo del colore. Portare a volume di 1L con acqua distillata.
Misurare l'assorbanza della soluzione campione a λ=555 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Boro in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,4,graficamente si ricava che la concentrazione di Boro è pari a 0,12mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,32x+0,002 (0,4=3,32x+0,002=0,12mg/L). Poichè il campione d'acqua è di 1ml si ha che: (1*0,12)/1000=0,00012mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Boro pari a 1000000L*0,00012mg/L=120mg
Possibili interferenze nell'analisi:
Nitrati- interferisce se presente con una concentrazione di 15 mg/L come azoto N.
Fosforo
Determinazione spettroscopica UV-VIS
Campione:il campione di acqua deve essere raccolto in contenitori di plastica.
Reagenti
Soluzione di molibdato di ammonio. Sciogliere 15 g di eptamolibdato di esammonio tetraidrato in 500 mL di acqua. La soluzione conservata in bottiglie di plastica al riparo dalla luce, è stabile per molti mesi.
Soluzione di acido solforico. Versare cautamente 140 mL di acido solforico concentrato in 900 mL di acqua. Soluzione di acido ascorbico. Sciogliere 27 g di acido ascorbico in 500 mL di acqua.Conservare la soluzione in bottiglie di plastica ed in frigorifero. In tal modo è stabile per molti mesi.
Soluzione di tartrato di ossido di antimonio e potassio. Sciogliere 0,34 g di tartrato di ossido di
antimonio(III) e di potassio emiidrato in 250 mL di acqua, scaldando se necessario.La soluzione, conservata in bottiglie di vetro o di plastica, è stabile per molti mesi.
Reagente misto. Mescolare 100 mL della soluzione di molibdato di ammonio con 250 mL di soluzione di acido solforico, 100 mL di soluzione di acido ascorbico e 50 mL di soluzione di tartrato di antimonio e potassio. Il reagente, preparato al momento dell'uso.
Soluzione standard concentrata di fosforo. Sciogliere con acqua 0,4393 g di diidrogenofosfato di potassio anidro, seccato a 105°C, e diluire con acqua a 1L in matraccio tarato.1ml di soluzione contiene 0,1mg di P(in 1L=1000ml=1000*0,1=100mg). Conservare la soluzione in bottiglia scura, previa aggiunta di 1 mL di cloroformio.
Soluzione standard diluita di fosforo (1 mL = 0,001 mg di P). Prelevare 10 mL della soluzione
standard di fosforo concentrata e diluire a 1L con acqua in matraccio tarato.1ml di soluzione contiene 0,001mg di P(in 1L=1000ml=1000*0,001=1mg).
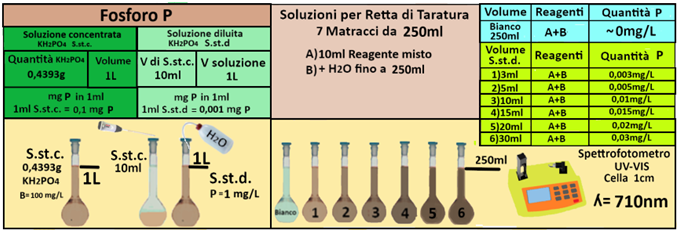
In 6 matracci da 250ml trasferire rispettivamente 3-5-10-15-20 e 30ml di soluzione diluita di fosforo e aggiungere 10ml di reagente misto. Allo stesso modo preparare un bianco sempre da 250ml.
Dopo 10 minuti costruire la retta di taratura utilizzando uno spettrofotometro alla lunghezza
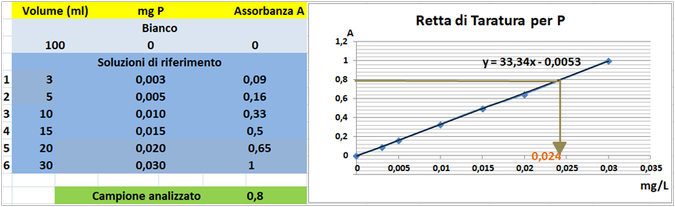
d'onda di 710nm e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di fosforo nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,003-0,005-0,01-0,015-0,02 e 0,03 mg/L.
Prelevare 100 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 250 mL con 10ml di reagente misto.Portare a volume con acqua distillata e dopo 10 minuti misurare l'assorbanza del campione a λ=710 nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Fosforo in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,8,graficamente si ricava che la concentrazione di Fosforo è pari a 0,024mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=33,34x-0,0053 (0,8=33,34x-0,0053 x=0,024mg/L).
Poichè il campione d'acqua è di 100ml si ha che: (100*0,024)/1000=0,0024mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Fosforo pari a 1000000L*0,0024mg/L=2400mg=2,4g
Possibili interferenze nell'analisi:
Rame- interferisce se presente con una concentrazione di 10 mg/L.
Ferro- interferisce se presente con una concentrazione di 50 mg/L.
Nitriti - interferiscono se presenti con una concentrazione di 1 mg/L.
Potassio
Spettroscopia di assorbimento atomico a fiamma (aria-acetilene)
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido cloridrico concentrato [HCl] (d = 1,19).
Soluzione standard concentrata di potassio - Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 1,907g di KCl, essiccato a 110 °C in un matraccio da 1L e portare a volume con acqua.
Soluzione diluita di potassio - Trasferire 1mL della soluzione standard concentrata in un matraccio da 100mL e portare a volume con acqua.Oppure trasferire 1ml di soluzione AAS in un matraccio da 100mL e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Potassio.
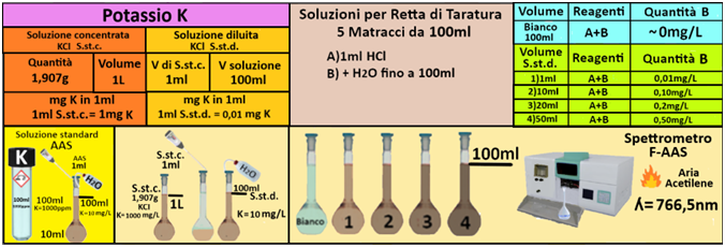
Prelevare e trasferire in 4 matracci da 100ml 1-10-20 e 50ml della soluzione standard diluita di potassio,1 mL di HCl concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a fiamma alla
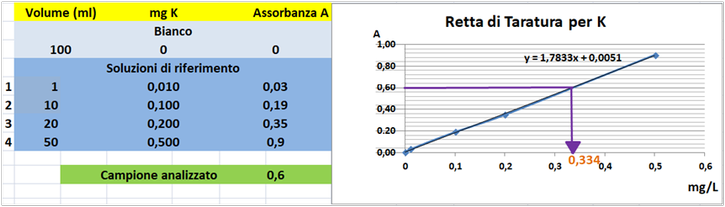
lunghezza d'onda di 766,5nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Potassio nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,01-0,1-0,2-0,5mg/L.
Prelevare 80 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 1ml di HCl concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=766,5nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Potassio
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Potassio
è pari a 0334mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=1,7833x-0,0051 (0,6=1,7833x-0,0051 x=0,334mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Potassio
è pari a 0334mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=1,7833x-0,0051 (0,6=1,7833x-0,0051 x=0,334mg/L).
Poichè il campione d'acqua è di 80ml si ha che: (80*0,334)/1000=0,0267mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Potassio
pari a 1000000L*0,02672mg/L=26720mg=26,72g
pari a 1000000L*0,02672mg/L=26720mg=26,72g
Possibili interferenze nell'analisi: non rilevanti.
Calcio

Spettroscopia di assorbimento atomico a fiamma (aria-acetilene)
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido cloridrico concentrato [HCl] (d = 1,19).
Acido cloridrico (1;1). Aggiungere un volume di HCl concentrato ad 1 volume di acqua.
Acido cloridrico (1:99). Aggiungere un volume di HCl concentrato a 99 volumi di acqua.
Soluzione di lantanio (10% La). Sciogliere 117,276 g di ossido di lantanio in poca acqua,aggiungere 250 mL di acido cloridrico concentrato e portare a volume di 1L con acqua.
Soluzione standard concentrata di calcio - Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 2,5 g di CaCO3, essiccato a 180 °C in un matraccio da 1L,aggiungere quanto basta di HCl (1:1) per scioglierlo e portare a volume con HCl (1:99).
Soluzione diluita di calcio- Trasferire 1mL della soluzione standard concentrata in un matraccio da 100mL e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Calcio.
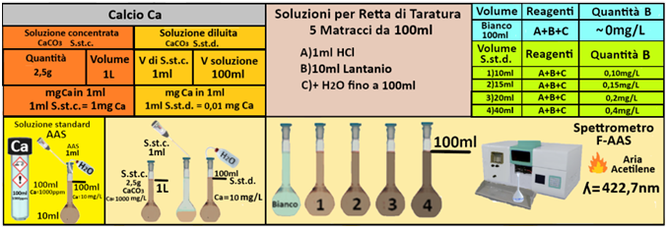
Prelevare e trasferire in 4 matracci da 100ml 1-15-20 e 40ml della soluzione standard diluita di potassio,1 mL di HCl concentrato,10ml di soluzione di lantanio e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di
assorbimento a fiamma alla lunghezza d'onda di 422,7nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Calcio nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,1-0,15-0,2-0,4mg/L.
Prelevare 80 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 1ml di HCl concentrato,10ml di soluzione di lantanio e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=422,7nm.
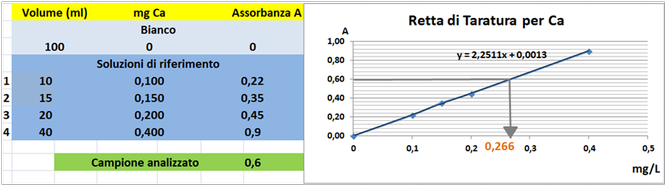
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Calcio
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Calcio
è pari a 0,266mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2511x-0,0013 (0,6=2,2511x-0,0013 x=0,266mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Calcio
è pari a 0,266mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2511x-0,0013 (0,6=2,2511x-0,0013 x=0,266mg/L).
Poichè il campione d'acqua è di 80ml si ha che: (80*0,266)/1000=0,0213mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Calcio
pari a 1000000L*0,0213mg/L=21280mg=21,28g
pari a 1000000L*0,0213mg/L=21280mg=21,28g
Magnesio

Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido cloridrico concentrato [HCl] (d = 1,19).
Acido cloridrico (1:99). Aggiungere un volume di HCl concentrato a 99 volumi di acqua.
Soluzione di lantanio (10% La). Sciogliere 117,276 g di ossido di lantanio (La2O3) in poca acqua,
aggiungere 250 mL di acido cloridrico concentrato e portare a volume di 1L con acqua.
Acido cloridrico (1:1). Aggiungere un volume di HCl concentrato ad 1 volume di acqua.
Soluzione standard concentrata di magnesio - Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 1 g di magnesio metallico in un matraccio da 1L,aggiungere quanto basta di HCl (1:1) per scioglierlo e portare a volume con HCl (1:99).
Soluzione diluita di magnesio- Trasferire 1mL della soluzione standard concentrata in un matraccio da 100mL e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Magnesio
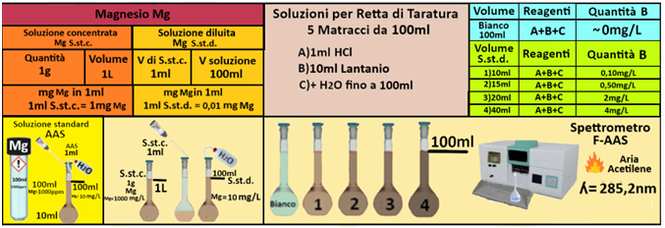
Prelevare e trasferire in 4 matracci da 100ml 10-15-20 e 40ml della soluzione standard diluita di Magnesio,1 mL di HCl concentrato,10ml di soluzione di lantanio e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di
assorbimento a fiamma alla lunghezza d'onda di 285,2nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Magnesio nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,04-0,17-0,6-1,2mg/L.
Prelevare 80 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 1ml di HCl concentrato,10ml di soluzione di lantanio e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=285,2nm.
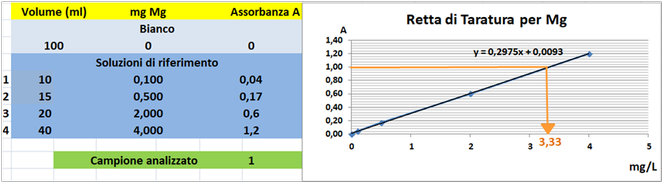
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Magnesio
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 1,graficamente si ricava che la concentrazione di Magnesio
è pari a 3,33mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2975x-0,0093 (1=2,2975x-0,0093 x=3,33mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 1,graficamente si ricava che la concentrazione di Magnesio
è pari a 3,33mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2975x-0,0093 (1=2,2975x-0,0093 x=3,33mg/L).
Poichè il campione d'acqua è di 80ml si ha che: (80*3,33)/1000=0,266mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Magnesio
pari a 1000000L*0,266mg/L=266000mg=266g
pari a 1000000L*0,266mg/L=266000mg=266g
Possibili interferenze nell'analisi: non rilevanti.
Sodio
Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido cloridrico concentrato [HCl] (d = 1,19).
Soluzione standard concentrata di sodio - Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 2,542 g di cloruro di sodio essiccato a 180 °C in un matraccio da 1L e portare a volume con con acqua.
Soluzione diluita di sodio- Trasferire 1mL della soluzione standard concentrata in un matraccio da 100mL e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Sodio

Prelevare e trasferire in 4 matracci da 100ml 10-15-25 e 35ml della soluzione standard diluita di Sodio,1 mL di HCl concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a
fiamma alla lunghezza d'onda di
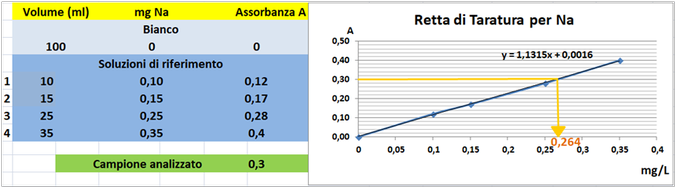
589nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Sodio nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,1-0,15-0,25-0,35mg/L.
Prelevare 80 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 1ml di HCl concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=589nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Sodio
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,3,graficamente si ricava che la concentrazione di Sodio
è pari a 0,264mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2975x-0,0093 (0,3=1,1315x-0,0016 x=0,264mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,3,graficamente si ricava che la concentrazione di Sodio
è pari a 0,264mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=2,2975x-0,0093 (0,3=1,1315x-0,0016 x=0,264mg/L).
Poichè il campione d'acqua è di 80ml si ha che: (80*0,264)/1000=0,021mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Sodio
pari a 1000000L*0,021mg/L=21000mg=21g
pari a 1000000L*0,021mg/L=21000mg=21g
Possibili interferenze nell'analisi: non rilevanti.
Ferro
Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
HCl 1:1
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di ferro - Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 1 g di ferro metallico in polvere in un matraccio da 1L e aggiungere 100ml di HCl 1:1 riscaldando. Raffreddare e portare a volume con con acqua.
Soluzione diluita di ferro -Trasferire 1mL della soluzione standard concentrata in un matraccio da 1L,e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Ferro.
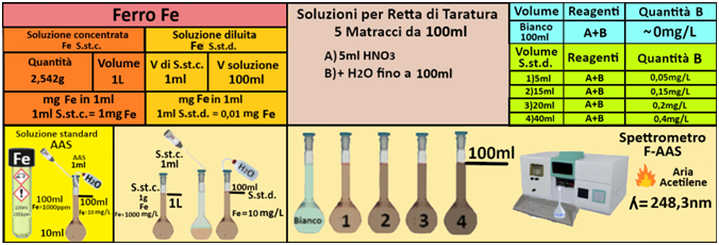
Prelevare e trasferire in 4 matracci da 100ml 5-15-20 e 40ml della soluzione standard diluita di Ferro,1 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a fiamma
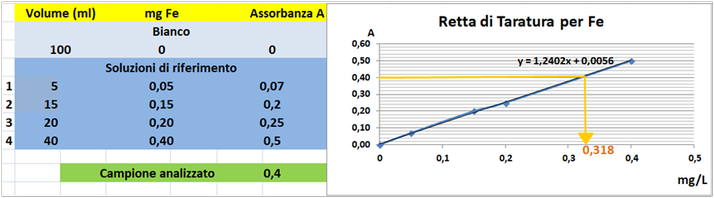
alla lunghezza d'onda di 248,3nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Ferro nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,05-0,15-0,20-0,40mg/L.
Prelevare 100 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=248,3nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Ferro
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,4,graficamente si ricava che la concentrazione di Ferro
è pari a 0,318mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=1,2402x-0,0056 (0,4=1,2402x-0,0056 x=0,318mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,4,graficamente si ricava che la concentrazione di Ferro
è pari a 0,318mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=1,2402x-0,0056 (0,4=1,2402x-0,0056 x=0,318mg/L).
Poichè il campione d'acqua è di 100ml si ha che: (100*0,318)/1000=0,0318mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Ferro
pari a 1000000L*0,0318mg/L=31800mg=31,8g
pari a 1000000L*0,0318mg/L=31800mg=31,8g
Possibili interferenze nell'analisi
Sodio, potassio, cloruri, solfati - interferiscono se presenti con una concentrazione di 5 mg/L.
Manganese, cobalto,rame, zinco, boro, molibdeno - interferiscono se presenti con una concentrazione di 100 mg/L
Manganese

Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di Manganese- Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 3,076 g di solfato di manganese monoidrato in un matraccio da 1L e aggiungere 10ml di di HNO3 concentrato. Portare a volume con con acqua.
Soluzione diluita di Manganese -Trasferire 1mL della soluzione standard concentrata in un matraccio da 1L e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Manganese.
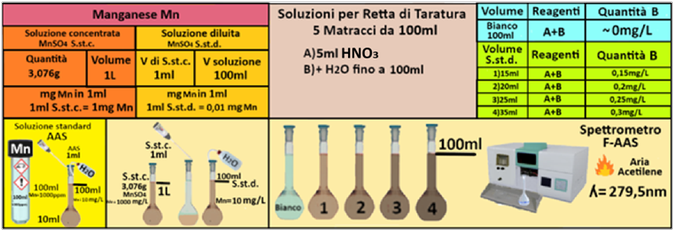
Prelevare e trasferire in 4 matracci da 100ml 15-20-25 e 40ml della soluzione standard diluita di Manganese,5 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a fiamma
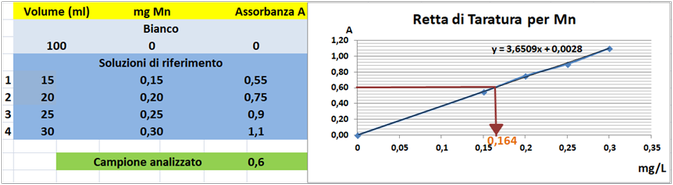
alla lunghezza d'onda di 279,5nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Manganese nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,15-0,20-0,25 e 0,30mg/L.
Prelevare 100 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=279,5nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Manganese
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Manganese
è pari a 0,164mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,6509x-0,0028 (0,6=3,6509x-0,0028 x=0,164mg/L).
in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Manganese
è pari a 0,164mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,6509x-0,0028 (0,6=3,6509x-0,0028 x=0,164mg/L).
Poichè il campione d'acqua è di 100ml si ha che: (100*0,164)/1000=0,0164mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Manganese
pari a 1000000L*0,0164mg/L=16400mg=16,4g
pari a 1000000L*0,0164mg/L=16400mg=16,4g
Possibili interferenze nell'analisi: non rilevanti.
Zinco

Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di zinco -Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 3,076g di ossido di zinco in un matraccio da 1L e aggiungere 10ml di di HNO3 concentrato. Portare a volume con con acqua.
Soluzione diluita di zinco-Trasferire 1mL della soluzione standard concentrata in un matraccio da 1L e portare a volume con acqua.La soluzione diluita contiene 10mg/L di Zinco.
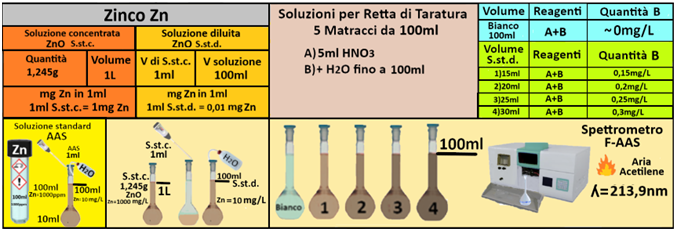
Prelevare e trasferire in 4 matracci da 100ml 15-20-25 e 30ml della soluzione standard diluita di Zinco,5 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a fiamma alla

lunghezza d'onda di 213,9nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Zinco nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,57-0,75-0,9 e 1,1mg/L.
Prelevare 100 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=213,9nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Zinco in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,8,graficamente si ricava che la concentrazione di Zinco
è pari a 0,217mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,6396x-0,0089 (0,8=3,6396x-0,0089 x=0,217mg/L).
è pari a 0,217mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,6396x-0,0089 (0,8=3,6396x-0,0089 x=0,217mg/L).
Poichè il campione d'acqua è di 100ml si ha che: (100*0,217)/1000=0,0217mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Zinco
pari a 1000000L*0,0217mg/L=21700mg=21,7g
pari a 1000000L*0,0217mg/L=21700mg=21,7g
Possibili interferenze nell'analisi:
Sodio, potassio, cloruri, solfati - interferiscono se presenti con una concentrazione di 9 mg/L.
Rame e Cobalto - interferiscono se presenti con una concentrazione di 10 mg/L
Calcio e Magnesio - interferiscono se presenti con una concentrazione di 4mg/L
Nitrati - interferiscono se presenti con una concentrazione di 2mg/L
Ferro - interferisce se presente con una concentrazione di 100mg/L
Rame

Spettroscopia di assorbimento atomico con bruciatore per aria-acetilene
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di rame-Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 1 g di rame in polvere in un becker,aggiungere 15ml di di HNO3 e 15 mL di acqua. Scaldare fino a completa dissoluzione. Raffreddare,trasferire in un matraccio da 1L e portare a volume con con acqua.
Soluzione diluita di rame-Trasferire 1mL della soluzione standard concentrata in un matraccio da 1L e portare a volume con acqua.La soluzione diluita contiene 10mg/L di rame .
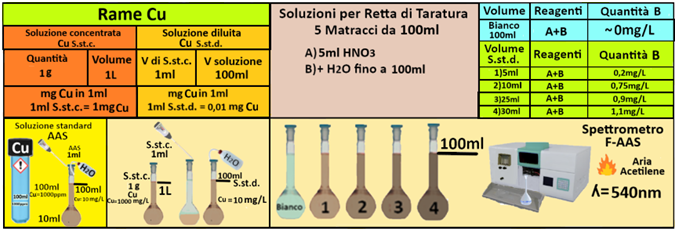
Prelevare e trasferire in 4 matracci da 100ml 5-10-25 e 30ml della soluzione standard diluita di Rame,5 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento a fiamma alla
lunghezza d'onda di 540nm con fornetto ad aria-acetilene e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Rame nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,05-0,75-0,9 e 1,1mg/L.
Prelevare 50 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=540nm.
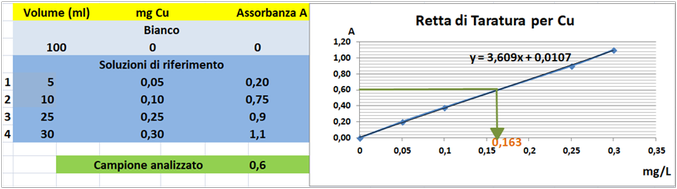
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Rame in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,6,graficamente si ricava che la concentrazione di Rame
è pari a 0,163mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,609x-0,0107 (0,6=3,609x-0,0107 x=0,163mg/L).
è pari a 0,163mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=3,609x-0,0107 (0,6=3,609x-0,0107 x=0,163mg/L).
Poichè il campione d'acqua è di 50ml si ha che: (50*0,163)/1000=0,00815mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Rame
pari a 1000000L*0,00815mg/L=8150mg=8,15g
pari a 1000000L*0,00815mg/L=8150mg=8,15g
Possibili interferenze nell'analisi:
Zinco,Manganese,Cobalto - interferiscono se presenti con una concentrazione di 3 mg/L.
Ferro - interferisce se presente con una concentrazione di 10mg/L
Fosfati,Solfati e Cloruri - interferiscono se presenti con una concentrazione di 1000 mg/L
Molibdeno

Spettroscopia di assorbimento atomico con bruciatore a fornetto di grafite
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di molibdeno -Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 1,2875 g di molibdato ammonico in un matraccio da 100ml,aggiungere 1ml di di HNO3 e portare a volume con con acqua.
Soluzione diluita di molibdeno -Trasferire 0,2 mL della soluzione standard concentrata in un matraccio da 100mL,e portare a volume con acqua.La soluzione diluita contiene 2mg/L di molibdeno.

Prelevare e trasferire in 4 matracci da 100ml 5-10-25 e 30ml della soluzione standard diluita di Molibdeno,5 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro
di assorbimento a fiamma alla lunghezza d'onda di 313,3nm con fornetto di grafite e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Molibdeno nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,01-0,02-0,05 e 0,06mg/L.
Prelevare 50 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=313,3nm.
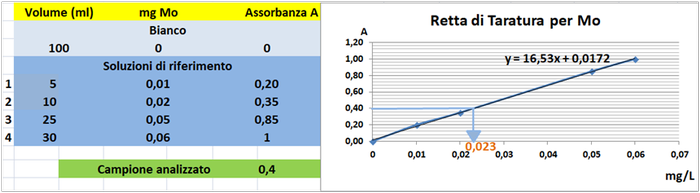
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Molibdeno in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 0,4,graficamente si ricava che la concentrazione di Molibdeno
è pari a 0,023mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=16,53x-0,0172 (0,4=16,53x-0,0172 x=0,023mg/L).
è pari a 0,023mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=16,53x-0,0172 (0,4=16,53x-0,0172 x=0,023mg/L).
Poichè il campione d'acqua è di 50ml si ha che: (50*0,023)/1000=0,00115mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Molibdeno
pari a 1000000L*0,00115mg/L=1150mg=1,15g
pari a 1000000L*0,00115mg/L=1150mg=1,15g
Possibili interferenze nell'analisi: non rilevanti.
Cobalto

Spettroscopia di assorbimento atomico con bruciatore a fornetto di grafite
Campione:il campione di acqua deve essere raccolto in contenitori di plastica dopo filtrazione su membrana
da 0,45 μm e acidificato fino a pH<2 con HNO3.Il campione deve essere analizzato in tempi brevi e si conserva per una settimana.
Reagenti
Acido nitrico concentrato (d=1,40)
Soluzione concentrata di Cobalto-Utilizzare le soluzioni in commercio specifiche per AAS. Oppure trasferire 0,5 g di cobalto nitrato in un matraccio da 100ml,aggiungere 1ml di di HNO3 e portare a volume con con acqua.
Soluzione diluita di Cobalto-Trasferire 0,2 mL della soluzione standard concentrata in un matraccio da 100mL,e portare a volume con acqua.La soluzione diluita contiene 2mg/L di Cobalto.
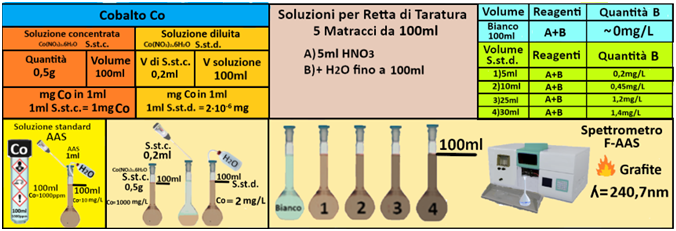
Prelevare e trasferire in 4 matracci da 100ml 5-10-25 e 30ml della soluzione standard diluita di Cobalto,5 mL di Acido nitrico concentrato e portare a volume con acqua. Allo stesso modo preparare un bianco sempre da 100ml.Costruire la retta di taratura utilizzando uno spettrometro di assorbimento
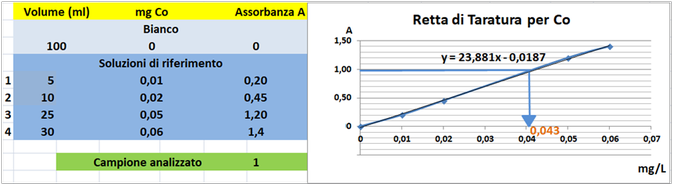
a fiamma alla lunghezza d'onda di 240,7nm con fornetto di grafite e riportare i valori delle Assorbanze del bianco e delle soluzioni di riferimento calcolando che la quantità di Cobalto nel bianco è pari praticamente a 0 mentre nelle soluzioni è pari rispettivamente a 0,01-0,02-0,05 e 0,06mg/L.
Prelevare 50 mL di campione d'acqua da analizzare e trasferirlo in un matraccio da 100 mL con 5ml di Acido nitrico concentrato e portare a volume con acqua distillata.Misurare l'assorbanza del campione a λ=240,7nm.
Tramite la retta di taratura costruita ponendo in ascisse le concentrazioni di Cobalto in mg/L e in ordinate le assorbanze corrispondenti e assumendo,per esempio,che l'assorbanza misurata del campione sia pari a 1,graficamente si ricava che la concentrazione di Cobalto è pari a 0,043mg/L.Al risultato si perviene anche risolvendo l'equazione del grafico y=23,881x-0,0187 (1=23,881x-0,0187 x=0,043mg/L).
Poichè il campione d'acqua è di 50ml si ha che: (50*0,043)/1000=0,00215mg/L.Supponendo che per una determinata coltura occorre fornire 1000m3=1000000L d'acqua si ha un apporto di Cobalto
pari a 1000000L*0,00215mg/L=2150mg=2,15g
pari a 1000000L*0,00215mg/L=2150mg=2,15g
Possibili interferenze nell'analisi:
Ferro,Rame,Zinco, e Manganese - interferiscono se presenti con una concentrazione di 10 mg/L
